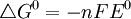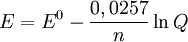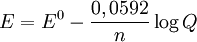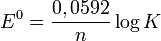A Equação de Nernst, desenvolvida pelo químico e físico alemão Walther Hermann Nernst, é a relação quantitativa que permite calcular a força eletromotriz de uma pilha, para concentrações de íons diferentes de uma unidade. Também usado para cálculos em titulação de oxidação-redução.
A variação de energia livre, ΔG, de qualquer reação e variação de energia livre padrão, ΔG°, estão relacionadas por meio da seguinte reação:
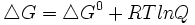
Onde Q é a expressão da lei de
ação das massas da reação. Para uma reação de oxido-redução, temos
que:
e
Assim, para uma reação redox, temos:
-
− nFE = − nFE0 + RTlnQ
ou
Sendo:
R = 8,315 J K-1
mol-1;
T = 298,2 K (25°C);
F = 96485 C mol-1
Substituindo na equação acima os valores de R, T e P, tem-se:
De forma alternativa, esta equação pode ser escrita em termos de
logarítmo decimal:
Nessa equação, o significado de seus componentes é o seguinte: Eº é
a força eletromotriz ou potencial normal da pilha correspondente
(que se obtém a partir dos potenciais normais dos eletrodos); R é a
constante universal dos gases; T é a temperatura em escala absoluta;
F é a carga elétrica de um mol de elétrons; n é o número de elétrons
transferidos; Q é o quociente de reação. Esse quociente é o produto
das concentrações das espécies ativas do segundo membro da reação de
oxi-redução, elevadas a seus respectivos coeficientes
estequiométricos (coeficientes que precedem as fórmulas na equação
química equilibrada), e seu denominador é o produto análogo das
concentrações dos reagentes.
Potenciais-padrão e constantes de equilíbrio
Quando um sistema atinge o equilíbrio, a energia livre dos produtos é igual à energia livre dos reagentes, ou seja, ΔG = 0. Quando este sistema pertence a uma célula galvânica, a célula não produz tensão, ou seja, "E" da célula é zero, pois não existe reação ocorrendo em nenhum dos sentidos. No equilíbrio, a expressão Q da lei de ação das massas passa a ser igual a K. Sendo assim, nestas condições, a equação de Nernst passa a ser escrita como:
ou
Que a 25°C, fica:
ou
Em qualquer uma destas formas, torna-se possível calcular E0
a partir de K, ou vice versa.
Agora vamos aplicar......
Exemplo 1
Vamos analisar a pilha de Daniell, a 25 oC. Temos que a reação global é:
Zn(s) + Cu2+(aq)
® Zn2+(aq) + Cu(s) ; ΔE° = 1,1 VUtilizando a equação de Nernst, temos:

Podemos fazer as seguintes observações:
Obs. 1: se a concentração de Zn2+ e de Cu2+ forem iguais a 1M, temos:

o que torna a ddp igual a 1,1V (ddp padrão)
Obs. 2: conforme a pilha é descarregada, temos que [Zn2+] aumenta e que [Cu2+] diminui, fazendo [Zn2+]/[Cu2+] aumentar. Assim, temos que a ddp da pilha tende a diminuir. Podemos notar no gráfico abaixo como a ddp de uma pilha de Daniell, com concentração inicial dos íons 1M varia enquanto a pilha se descarrega.

A carga decresce assintoticamente enquanto [Cu2+] diminui e [Zn2+] aumenta. Quando
ΔE é zero, temos que a reação atinge o estado de equilíbrio. Não teremos mais corrente pelo circuito externo e a pilha está descarregada. Poderíamos iniciar a reação com quaisquer concentrações. Por exemplo, utilizemos [Zn2+] = 1M e [Cu2+] = 0,1M.Temos que:

Exemplo 2
Agora calcularemos a ddp do exemplo abaixo, utilizando a equação de Nernst.
Zn(s) | Zn2+ (0,024 M) || Zn2+ (2,4 M) | Zn(s)
Cátodo: Zn2+ (2,4 M) + 2 e- ® Zn
Ânodo: Zn ® Zn2+ (0,024 M) + 2 e-
Reação Global: Zn2+ (2,4 M)
® Zn2+ (0,024 M), ΔE° = 0 VUtilizando a equação de Nernst, temos:

- Nota-se que a ddp é positiva. A reação é espontânea e portanto é realmente uma pilha, como se esperava. Note que a espontaneidade é confirmada se pensarmos que na reação final os íons Zn2+ se deslocam da solução concentrada para a solução diluída.
- Se tivéssemos a reação inversa, Zn2+(0.024M)
® Zn2+(2.4 M), a ddp seria –0,0592V, ou seja, a reação não seria espontânea.- Se as concentrações se igualarem, teremos que
ΔE = 0 e portanto a pilha para de funcionar (encontra o equilíbrio)Esta é conhecida como uma pilha de concentração, ou seja, pilhas nas quais os dois eletrodos são iguais e estão mergulhados em soluções de seus íons, porém em concentrações diferentes.
Exemplo 3
Agora mostraremos que a ddp de uma pilha não é afetada pela multiplicação da reação por um número:
Imaginemos a seguinte pilha: Mg | Mg2+ || Ag+ | Ag
Duas reações possíveis para essa pilha são:
Mg + 2 Ag+ ® Mg2+ + 2 Ag
2 Mg + 4 Ag+ ® 2 Mg2+ + 4 Ag
Utilizando a equação de Nernst:

Note que:

EXEMPLO 4
Podemos ainda calcular, por exemplo, a concentração de uma célula em equilíbrio (pilha descarregada). Exemplifiquemos:
Dada a ddp padrão da reação Fe + Zn2+ ® Zn + Fe2+ igual a –0,353V. Se um pedaço de ferro é colocado em uma solução mantida a uma concentração constante de 1 molar de Zn2+, qual seria a concentração de equilíbrio de Fe2+?
Utilizando a equação de Nernst:

A equação de Nernst pode ser ainda aplicada às semi-reações que aparecem na Tabela dos Potenciais Padrão de eletrodo. Como o padrão hidrogênio tem Eº = 0, por convenção, a equação se simplifica para:

Assim considerada, por exemplo, a equação Zn2+ + 2e- ® Zn Eº =-0,76V
Tem potencial em função da concentração de Zn2+ igual a:

Já a reação inversa:

Faça em casa......
Exercícios
(vide o gabarito no final da lista)
1. Escreva a equação de Nernst e calcule
ΔE para as seguintes reações (utilize a tabela de potenciais e log2=0,301):a) Cu2+(0,1M) + Zn ® Cu + Zn2+(1,0M)
b) Sn2+(0,5M) + Zn ® Cu + Zn2+(0,01M)
c) F2(1atm) + 2Li ® 2Li+(1M) + 2F-(0,5M)
d) 2H+(0,01M) + Zn ® H2(1atm) + Zn2+(1,0M)
e) 2H+(0,1M) + Fe ® H2(1atm) + Fe2+(1,0M)
f) 2 Al + 3 Ni2+(0,8M) ® 2 Al3+(0,02M) + 3 Ni
g) Cu+(0,05M) + Zn ® Cu + Zn2+(0,01M)
h) PbO2 + SO42-(0,01M) + 4 H+(0,1M) +Cu ® PbSO4 + 2 H2O + Cu2+(0,001M)
2. Calcule a ddp da pilha Cr,Cr3+(0,1M)|Sn2+(0,001M),Sn, Dados os potenciais padrão de redução. (Eº Sn = -0,14V e Eº Cr = -0,74V)
3. Calcule a ddp da seguinte pilha a 25oC:
Fe, Fe2+(0,02M)|Cu2+(0,2M), Cu
Dados potenciais padrão de redução (Eº Fe = -0,44V e Eº Cu = +0,40V)
4. Calcule o potencial gerado por uma pilha de concentração consistindo em um par de eletrodo de ferro mergulhados em duas soluções, uma contendo Fe2+ 0,1M e a outra contendo Fe2+ 0,001M.
5. Calcule o potencial de uma pilha de concentração contendo Cr3+ 0,002M em um compartimento e Cr3+ 0,1M no outro compartimento com eletrodos de Cr mergulhados em cada solução. (Utilize log2 = 0,3010)
6. Qual o potencial de redução de uma meia pilha composta de um fio de cobre imerso em CuSO4, 2.10-4M? (Eº RED = 0,34V, log2=0,301)
7. Uma pilha foi construída usando-se o eletrodo padrão de hidrogênio ([H+]=1M e pH2=1atm) em um compartimento e um eletrodo de chumbo em uma solução 0,1 M de K2CrO4 em contato com PbCrO4 não dissolvido. O potencial da pilha foi medido como 0,51V, com o eletrodo de Pb servindo de ânodo. Determine o valor de [Pb2+].[CrO42-], que é conhecido como produto de solubilidade (KPS).
8. Uma pilha galvânica foi construída usando-se prata como um eletrodo imerso em 200 cm3 de uma solução de AgNO3 0,1M e magnésio como outro eletrodo, imerso em 250 cm3 de solução Mg(NO3)2 0,1M. Sabendo que:
Ag+ + 1e- ® Ag Eº = 0,8V
Mg2+ + 2e- ® Mg Eº = -2,36V
a) qual o potencial da pilha?
b) Suponha que a pilha tenha ficado ligada o tempo necessário para que fosse depositado 1 g de prata no eletrodo de prata. Qual o potencial da pilha nesse momento?
9. (Olimpíada Brasileira de Química) Ouro metálico dissolve em água régia, uma mistura de ácido clorídrico e ácido nítrico concentrados e, na química do ouro, as seguintes reações são importantes:
Au3+(aq) + 3 e- ® Au(s) E° red = + 1,498 V
AuCℓ4-(aq) + 3 e- ® Au(s) + 4 Cℓ-(aq) E° red = + 1,002 V
Utilizando as semi-reações acima e a semi-reação:
NO3-(aq) + 4H+(aq) + 3e- ® NO(g) + 2H2O(ℓ) E° red = + 0,96 V
Responda às questões (a), (b), (c) e (d)
a) Dê a equação equilibrada da reação entre o ouro e o ácido nítrico, para formar Au3+ e NO(g) e calcule a fem-padrão (Eº) associada a esta reação. Esta reação é espontânea ?
b) Dê a equação da reação entre o ouro e o ácido clorídrico, formando AuCℓ
4- e H2(g) e calcule a fem-padrão (E° ) associada a esta reação. Esta reação, em condições-padrão, é espontânea?c) Dê a reação entre o ouro e a água régia para dar AuC
ℓ4- e NO(g) e calcule a fem-padrão (E° ) associada a esta reação. Esta reação é espontânea?d) Utilizando a equação de Nerst, explique a razão da água régia ser capaz de dissolver o ouro .
10. (ITA-2003) Considere o elemento galvânico mostrado na figura abaixo.

O semi-elemento A contém uma solução aquosa, isenta de oxigênio, 0,3 mol.L-1 em Fe2+ e 0,2 mol.L-1 em Fe3+. O semi-elemento B contém uma solução aquosa também isenta de oxigênio, 0,2 mol.L-1 em Fe2+ e 0,3 mol.L-1 em Fe3+. M é um condutor metálico (platina). A temperatura do elemento galvânico é mantida constante num valor igual a 25oC. A partir do instante em que a chave “S” é fechada, considere as seguintes afirmações:
I. O sentido convencional de corrente elétrica ocorre do semi-elemento B para o semi-elemento A
II. Quando a corrente elétrica for igual a zero, a relação [Fe3+]/[Fe2+] tem o mesmo valor tanto no semi-elemento A como no semi-elemento B
III. Quando a corrente elétrica for igual a zero, a concentração de Fe2+ no semi-elemento A será menor do que 0,3 mol.L-1
IV. Enquanto o valor da corrente elétrica for diferente de zero, a diferença de potencial entre os dois semi-elementos será maior do que 0,118log(3/2)
V. Enquanto corrente elétrica fluir pelo circuito, a relação entre as concentrações [Fe3+]/[Fe2+] permanece constante nos dois semielementos
Das afirmações feitas, estão corretas
a) apenas I, II e III
b) apenas I, II e IV
c) apenas III e V
d) apenas IV e V
e) todas
11. (ITA-2002) Um elemento galvânico é constituído pelos eletrodos abaixo especificados e separados por uma ponte salina.
ELETRODO I: placa de chumbo metálico mergulhada em uma solução aquosa 1 mol/L de nitrato de chumbo.
ELETRODO II: sulfato de chumbo prensado contra uma “peneira” de chumbo mergulhada em uma solução aquosa 1 mol/L de ácido sulfúrico.
Nas condições-padrão, o potencial de cada um destes eletrodos, em relação ao eletrodo padrão de hidrogênio, é:
E Pb/Pb2+ = + 0,1264 V (ELETRODO I).
E Pb/PbSO4, SO4-2 = + 0,3546 V (ELETRODO II)
Assinale a opção que contém a afirmação correta sobre as alterações ocorridas neste elemento galvânico quando os dois eletrodos são conectados por um fio de baixa resistência elétrica e circular corrente elétrica no elemento.
a) A massa de sulfato de chumbo sólido na superfície do ELETRODO II aumenta.
b) A concentração de íons sulfato na solução aquosa do ELETRODO II aumenta.
c) O ELETRODO I é o pólo negativo.
d) O ELETRODO I é o anodo.
e) A concentração de íons chumbo na solução aquosa do ELETRODO I aumenta.
12. (ITA-2002) Considere o elemento galvânico da QUESTÃO ANTERIOR, mas substitua a solução aquosa de Pb(NO3)2 do ELETRODO I por uma solução aquosa 1,00.10-5 mol/L de Pb(NO3)2, e a solução aquosa de H2SO4 do ELETRODO II por uma solução aquosa 1,00.10-5 mol/L de H2SO4. Considere também que a temperatura permanece constante e igual a 25ºC.
a) Determine a força eletromotriz deste novo elemento galvânico.
Mostre os cálculos realizados.
Agora, considerando que circula corrente elétrica no novo elemento galvânico, responda:
b) Qual dos eletrodos, ELETRODO I ou ELETRODO II, será o ânodo?
c) Qual dos eletrodos será o pólo positivo do novo elemento galvânico?
d) Qual o sentido do fluxo de elétrons que circula no circuito externo?
e) Escreva a equação química balanceada da reação que ocorre neste novo elemento galvânico?
13. (ITA-2006) Um elemento galvânico é constituído pelos eletrodos abaixo especificados, ligados por uma ponte salina e conectados a um multímetro de alta impedância.
Eletrodo a: Placa de chumbo metálico mergulhada em uma solução aquosa 1 mol.L-1 de nitrato de chumbo.
Eletrodo b: Placa de níquel metálico mergulhada em uma solução aquosa 1 mol.L-1 de sulfato de níquel.
Após estabelecido o equilíbrio químico nas condições-padrão, determina-se a polaridade dos eletrodos. A seguir, são adicionadas pequenas porções de KI sólido ao Eletrodo a, até que ocorra a inversão de polaridade do elemento galvânico.
Dados eventualmente necessários:
Produto de solubilidade de PbI2: Kps (PbI2) = 8,5 x 10-9
Potenciais de eletrodo em relação ao eletrodo padrão de hidrogênio nas condições-padrão:

Assinale a opção que indica a concentração CORRETA de KI, em mol L-1, a partir da qual se observa a inversão de polaridade dos eletrodos nas condições-padrão.
a) 1 x 10-2
b) 1 x 10-3
c) 1 x 10-4
d) 1 x 10-5
e) 1 x 10-6
14. (ITA-2007) Considere a reação química representada pela equação abaixo e sua respectiva força de eletromotriz nas condições padrão:
O2(g) + 4 H+(aq) + 4 Br-(aq) ® 2 Br2(g) + 2 H2O(ℓ)
ΔEº= 0,20 VAgora, considere que um recipiente contenha todas as espécies químicas dessa equação, de forma que todas as concentrações sejam iguais às das condições-padrão, exceto a de H+. Assinale a opção que indica a faixa de pH na qual a reação química ocorrerá espontaneamente.
a) 2,8<pH<3,4
b) 3,8<pH<4,4
c) 4,8<pH<5,4
d) 5,8<pH<6,4
e) 6,8<pH<7,4
15. (ITA-2005) Considere o elemento galvânico representado por:
Hg(ℓ)| eletrólito || C
ℓ− (solução aquosa saturada em KCℓ) | Hg2Cℓ2(s)|Hg(ℓ)a)Preveja se o potencial do eletrodo representado no lado direito do elemento galvânico será maior, menor ou igual ao potencial desse mesmo eletrodo nas condições-padrão. Justifique sua resposta.
b)Se o eletrólito no eletrodo à esquerda do elemento galvânico for uma solução 0,002 mol.L–1 em Hg2+ (aq), preveja se o potencial desse eletrodo será maior, menor ou igual ao potencial desse mesmo eletrodo nas condições-padrão. Justifique sua resposta.
c)Faça um esboço gráfico da forma como a força eletromotriz do elemento galvânico (ordenada) deve variar com a temperatura (abscissa), no caso em que o eletrodo do lado esquerdo do elemento galvânico seja igual ao eletrodo do lado direito nas condições-padrão.
16. (ITA-2006) Calcule o valor do potencial elétrico na escala do eletrodo de hidrogênio nas condições-padrão a semi-equação química
CuI(s) + e-(CM) ® Cu(s) + I-(aq).
Dados eventualmente necessários: Produto de solubilidade do CuI(s):
Kps (CuI) = 1,0 x 10-12
Semi-equações químicas e seus respectivos potenciais elétricos na escala do eletrodo de hidrogênio nas condições-padrão (Eº):
I. Cu2+(aq) + e-(CM)
® Cu+ (aq); EIº =0,15VII. Cu2+(aq) + 2e-(CM) ® Cu(s); EIIº =0,34V
III. Cu+(aq) + e-(CM) ® Cu(s); EIIIº =0,52V
IV. I2(s) + 2e-(CM) ® 2I-(aq); EIVº =0,54V