






|
|
Propriedades coligativas das soluções
- Pressão de vapor
Tonoscopia
Crioscopia
Ebulioscopia
Osmose

|
Pressão de vapor de um
líquido A a uma dada temperatura é a pressão do vapor de A no
equilíbrio líquido (A)
« vapor (A), nessa temperatura.
|
Imagine um cilindro fechado
contendo um líquido, com um espaço vazio acima da
altura do líquido, e um manômetro. Com o nível de
mercúrio dos dois ramos na mesma altura (figura a).
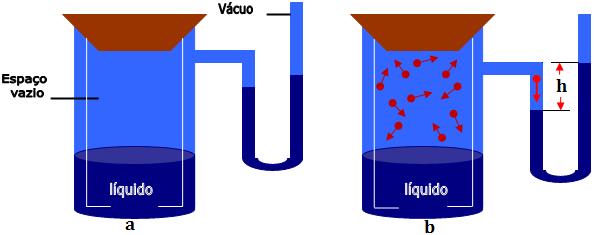
Primeiramente, as moléculas do
líquido se deslocam para o espaço vazio do cilindro,
formando a fase gasosa. A pressão exercida pelo
vapor do líquido é medida pelo manômetro. Notamos
que o nível do mercúrio sobe até certo ponto onde
estaciona (figura b). A pressão exercida pelo vapor
do líquido é medida pelo desnível h ente os dois
níveis de mercúrio.
A pressão máxima de
vapor é definida como a pressão exercida pelo vapor
em equilíbrio.
Até que a velocidade de vaporização atinja o
equilíbrio, ela é maior que a velocidade de
condensação. Conforme a quantidade de vapor aumenta,
a pressão do vapor também aumenta. A partir do
momento em que o equilíbrio é alcançado, a
concentração de moléculas na fase de vapor torna-se
constante e a pressão não aumenta mais, ou seja, o
seu valor máximo é atingido.
Como a superfície do líquido e a temperatura não se
alteram, a velocidade de vaporização é constante.
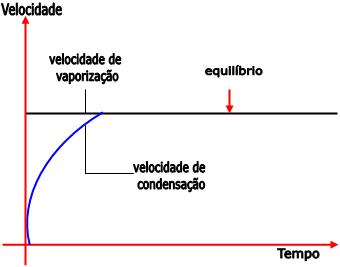
A velocidade de condensação
torna-se igual à velocidade de vaporização no
equilíbrio, ou seja, o número de moléculas que
abandonam o líquido se iguala ao número de moléculas
que voltam para o líquido.
A pressão máxima do vapor também pode ser chamada de
pressão de vapor ou pressão de vapor de equilíbrio.
Tal pressão é aquela que é exercida pelo vapor em
equilíbrio com o seu líquido.
Quando o vapor está em equilíbrio com o seu líquido,
ele é denominado vapor saturante.
A pressão de vapor
depende somente da natureza do liquido e da temperatura
A pressão de vapor depende exclusivamente da natureza do líquido
e da sua temperatura, não depende da quantidade de líquido nem
do espaço ocupado pelo vapor.
Pressão de Vapor e
Volatilidade
Quando as forças intermoleculares são muito
intensas, a vaporização é pouco provável e a pressão do vapor é
menor. Porém, se as moléculas não estiverem fortemente presas ao
líquido, a vaporização ocorre com facilidade e a pressão de
vapor é maior.
Podemos dizer que, sob uma temperatura de 20°C, a pressão máxima
de vapor de água é 17,5mm de Hg e a pressão máxima de vapor do
álcool etílico (etanol) é 44mm Hg. Portanto, o álcool é mais
volátil que a água.
Conforme a temperatura aumenta, ocorre também o aumento na
pressão de vapor do líquido. Portanto, sob uma temperatura de
27°C, a pressão máxima de vapor da água é de 26mm de Hg. E sob a
temperatura de 47°C a pressão máxima de vapor da água é de 79 mm
Hg. O diagrama abaixo representa essa relação entre pressão de
vapor e temperatura.
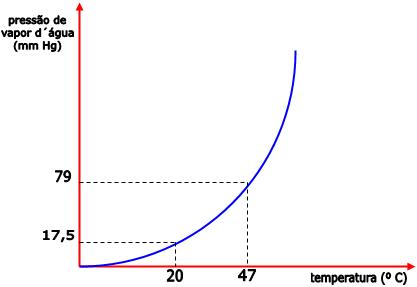
A pressão de vapor aumenta com a temperatura.
Vaporizando um líquido no interior de uma câmara
barométrica do tipo Torricelli, até ser atingido o equilíbrio
líquido «
vapor , o abaixamento da coluna de mercúrio
mede a pressão de vapor à temperatura da experiência.
Quanto maior é a pressão de vapor a uma mesma
temperatura, mais volátil é o líquido.
Pressão de vapor
e ponto de ebulição
Um líquido entra em ebulição quando a pressão de vapor do
líquido torna-se igual a pressão existente sobre a superfície do
líquido.
Quanto maior for a pressão de vapor nas condições ambientes, o
líquido ferverá mais facilmente, isto significa que, quanto
menor for o ponto de ebulição, mais volátil será o líquido.
Desse modo, sob uma temperatura de 20°C, a pressão máxima de
vapor de água é 17,5mm de Hg e a pressão máxima de vapor do
álcool é 44mm de Hg.
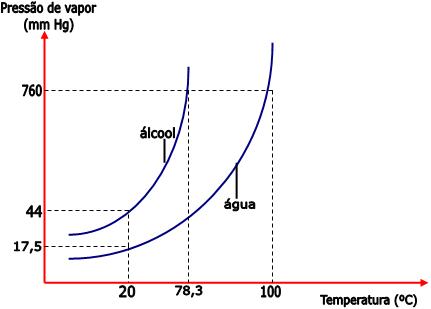
Observe no gráfico que, ao nível do mar (760
mmHg), o álcool etílico ferve a 78,3°C, e a água ferve a 100°C.
Portanto, conforme a temperatura aumenta, a pressão máxima de
vapor também aumenta. O álcool etílico entre em ebulição sob a
temperatura de 78,3°C, pois nesta temperatura a sua pressão
máxima de vapor se iguala à pressão atmosférica (760 mmHg à
nível do mar). Já a pressão máxima de vapor da água se iguala a
760mm Hg sob a temperatura de 100°C.
Pressão
de vapor e mudança de estado
 |
Um líquido entra em ebulição à temperatura em que a
sua pressão de vapor iguala-se à pressão exterior. Assim, a 100°C a água
tem pressão de vapor igual a 1 atm. Portanto, sob 1 atm a água entra em
ebulição a 100°C.
|
 |
A maioria dos sólidos funde-se com expansão de
volume. O gelo é uma das poucas exceções, fundindo-se com contração de
volume.
|
 |
O PF do gelo aumenta com a diminuição da pressão, e
vice-versa. Para a maioria dos sólidos, o PF aumenta com o aumento da
pressão, e vice-versa.
|
 |
O PE de todas as substâncias aumenta com o aumento da
pressão, e vice-versa.
|
 |
As variações dos PF são insignificantes com a
variação da pressão, porque no equilíbrio sólido «
líquido não há participante gasoso.
|
 |
As variações dos PE são significativas com a variação
da pressão, porque no equilíbrio líquido «
vapor há participante gasoso.
|
Ponto triplo
Ponto triplo de uma substância é um estado no qual se
estabelece o equilíbrio sólido
« líquido
« vapor . Somente
a uma determinada temperatura e pressão, que varia de uma substância para
outra, estabelece-se esse equilíbrio triplo.
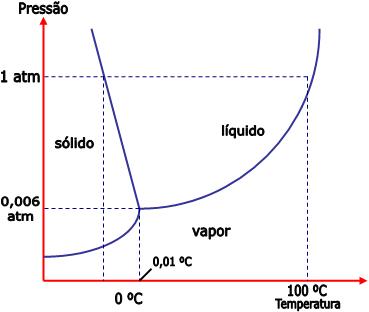
No caso da água, esse equilíbrio estabelece-se a, e
somente a, 0,01°C e 4,58 mmHg.
Não existe líquido a uma pressão inferior à do respectivo
ponto triplo. Assim, não existe água líquida a uma pressão menor que 4,58
mmHg.
A uma pressão inferior à do ponto triplo, ocorre somente
o equilíbrio sólido «
vapor (sublimação).
Substância que sublima à pressão ambiente tem a pressão
do ponto triplo acima da pressão ambiente (1 atm ao nível do mar). Exemplo:
gelo seco ou CO2 (s).
| Medida |
Símbolo |
| pressão de vapor da solução |
p |
| pressão de vapor do solvente |
p2 |
| fração molar do soluto |
X1 |
| fração molar do solvente |
X2 |
| constante tonoscópica molal |
Kt |
| massa molar do solvente |
M2 |
| molalidade da solução |
W |
| concentração da solução em mol/L |
[soluto] |
| grau de dissociação iônica |
a |
| número de íons/molécula |
q |
| fator de van't Hoff |
i |
| p |
= |
p2 . X2 |
Dp
__
p2 |
= |
X1 . i |
Dp
__
p2 |
@ |
Kt . W .
i |
| |
| somente para solução
aquosa: |
Dp
__
p2 |
@ |
Kt . [soluto] . i |
| Kt |
= |
10-3
M2 |
| Medida |
Símbolo |
| temperatura de congelação da solução |
Tc |
| temperatura de congelação do solvente |
Tc2 |
| constante crioscópica |
Kc |
| calor de fusão do solvente (cal/kg) |
Lc |
| Dtc |
= |
Kc . W . i |
|
| Kc |
= |
R* . (Tc2)2
________
Lc |
(Tc2 em kelvin) |
| Medida |
Símbolo |
| temperatura de ebulição da solução |
Te |
| temperatura de ebulição do solvente |
Te2 |
| constante ebulioscópica molal |
Ke |
| calor de vaporização do solvente (cal/kg) |
Le |
| Dte |
= |
Ke . W . i |
|
| Ke |
= |
R* . (Te2)2
_______
Le |
(Te2 em kelvin) |
Em todas as expressões onde aparece i (fator de van't Hoff):
| Medida |
Símbolo |
| pressão osmótica |
p |
| temperatura da solução |
T |
p
= [soluto] . R . T . i
Constante universal do gás ideal
Explicação do fenômeno da osmose
Considere uma campânula completamente fechada, contendo no seu
interior um recipiente com água pura e outro com solução aquosa
de glicose.
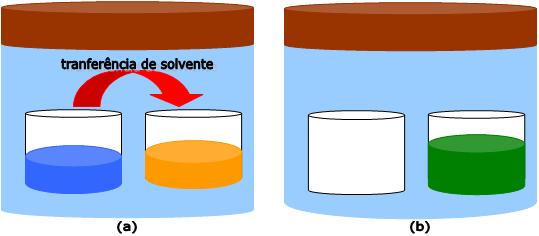
A água pura possui uma pressão de vapor maior do que solução,
isto significa que a água pura sofre evaporação com mais
facilidade. Conseqüentemente, há uma transferência de água do
recipiente da esquerda para o da direita.
Na osmose ocorre o mesmo, o solvente atravessa a membrana
semipermeável na forma de vapor, ocorrendo uma destilação do
mesmo, evaporando de um lado e condensando do outro.
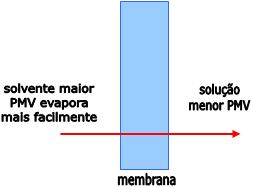
Osmose Reversa
Osmose reserva é um processo que consiste na aplicação de uma
pressão elevada para deixar a água fluir de uma concentração mais
concentrada para uma solução menos concentrada, através da membrana
semipermeável.
A osmose reserva é usada para a dessalinização das águas dos
oceanos. A pressão osmótica da água dos oceanos é da ordem de 30 atm.
Ao aplicar uma pressão maior que 30 atm à solução salina, o fluxo
osmótico será revertido, obtendo a água potável.
Home | Cinética Química | Eletroquímica | Equilíbrio Químico | Termoquímica | Propriedades Coligativas | Soluções
Este site foi atualizado em
04/03/19
|