PROFESSOR
PAULO CESAR
|
PROFESSOR PAULO CESAR |
|
|
|
|
|
QUÍMICA DESCRITIVA I
1. As partes
constituintes da Terra
Podemos analisar o planeta Terra se pensarmos em suas divisões: 1) Núcleo internos (sólido) 2) núcleo externo (líquido)
O interior da Terra
Composição da
atmosfera terrestre Os gases mais
abundantes na atmosfera terrestre
Características Preparação
industrial
3. Oxigênio
Preparação industrial Preparação em laboratório
4.
Nitrogênio
5.
Água
O processo inicia-se por meio de um compressor, no qual o ar é submetido a uma grande pressão, e no condensador o ar é transferido para a água, no liquidificador o ar se expande e resfria, e é reciclado, e quanto mais ele resfria-se mais rápido ele estará pronto, na temperatura necessária para se liquefazer.
Macromoléculas (H2O)n:
são moléculas de água que se juntam.
Diversificações da Água Água dura É quando há na água sais de
cálcio e magnésio, bicarbonato e sulfatos
dissolvidos nela. Pelo fato de conter os sais de
cálcio e magnésio ocorre à formação de
precipitados como os sais sódicos de ácidos
graxos, por isso, ela não produz espuma com
sabões.
Porém, a água dura possui a vantagem de ser calcificante de ossos e dentes.
Amolecimento da
água dura
Outra possibilidade é eliminar pela adição de NaCO3.
Possui óxido de deutério, e é parecida com a água ordinária em suas propriedades químicas, porém diferentes nas físicas.
Deutério é o isótopo do
hidrogênio, que possui 1 próton, 1 nêutron, 1
elétron.
Água potável
O hidróxido de alumínio não é
solúvel em água, por este fato, ele forma um
precipitado gelatinoso que forma flocos no qual
estão presas as partículas sólidas em suspensão.
6.
Halogênios
A ordem decrescente dos receptores de elétrons é:
O inverso é a reatividade dos íons haleto (X-) como doadores de elétrons:
I->Br->Cl->F-
O íon (I-)
prende o elétron mais externo, mais fracamente
que o íon cloreto (Cl-)
pelo fato que o íon (I-)
ser maior.
I2
+ I- → (I3)– Ocorre reação no cloro com bases
fortes, a frio ocorre produção de cloreto e
hipoclorito.
Preparação
7. Haletos de hidrogênio (HX)
Preparação 1- síntese: H2 + Cl2 → 2 HCl 2- reações de dupla-troca: Observações Ácido sulfúrico e a quente oxida o brometo e o iodeto. 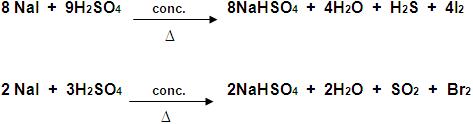 O ácido clorídrico comercial foi chamado de ácido muriático. Ácido fluorídrico (HF) É usado na gravação de vidros, ele
ataca a sílica e os silicatos.
Este site foi atualizado em 04/03/19 |