PROFESSOR
PAULO CESAR
|
PROFESSOR PAULO CESAR |
|
|
|
|
|
| Pilhas | |
| Espontaneidade das reações de oxirredução | |
| Corrosão | |
| Eletrólise |
Eletroquímica é
o estudo das reações nas quais ocorre conversão de energia química em
energia elétrica e vice-versa.
Numa pilha galvânica ocorre a conversão de energia química em energia
elétrica, já numa eletrólise ocorre a conversão de energia elétrica em
energia química.

Em eletroquímica estudamos as reações de oxidorredução que geram ou consomem energia.
A eletroquímica estuda as soluções eletrolíticas e os fenômenos que ocorrem quando são colocados eletrodos nestas soluções. Basicamente, a eletroquímica engloba o estudo das pilhas e da eletrólise.
Utilizando os sistemas abaixo, faremos algumas experiências.
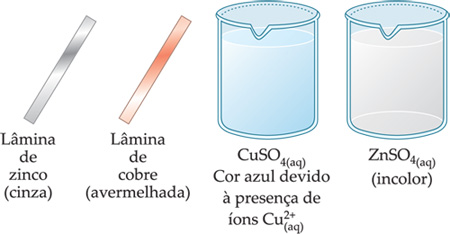
1a experiência: Uma lâmina de Cu(s) é mergulhada numa solução de ZnSO4(aq).
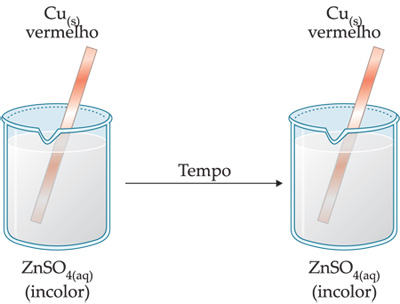
Cu(s) + ZnSO4(aq) → não ocorre reação
2a experiência: Uma lâmina de Zn(s) é mergulhada numa solução de CuSO4(aq).
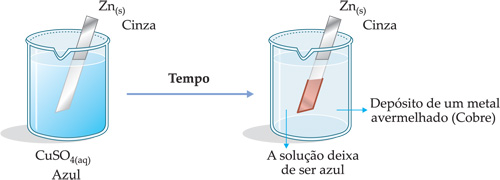
Reação ocorrida: Zn(s)
+ CuSO4(aq)
![]() ZnSO4(aq) + Cu(s)
ZnSO4(aq) + Cu(s)
(lâmina)
(solução) (solução) (lâmina)
Explicação:
– O íon
![]() “arranca” e– do Zn(s),
causando sua oxidação;
“arranca” e– do Zn(s),
causando sua oxidação;
– O íon
![]() apresenta capacidade de arrancar e–
do Zn(s) (é uma observação
experimental).
apresenta capacidade de arrancar e–
do Zn(s) (é uma observação
experimental).
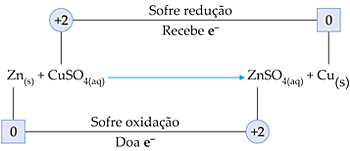
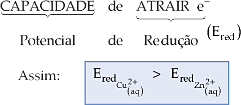
Analisando as duas experiências, concluímos que o
íon
![]() consegue arrancar e– do Zn(s),
já o íon
consegue arrancar e– do Zn(s),
já o íon
![]() não consegue arrancar e– do
Cu(s).
não consegue arrancar e– do
Cu(s).
Conclusões
– O íon
![]() possui maior capacidade de atrair (arrancar) e–
do que o íon
possui maior capacidade de atrair (arrancar) e–
do que o íon
![]()
– O Zn(s) possui maior capacidade de doar e– do que o Cu(s)
Cada íon metálico em solução apresenta uma diferente capacidade de atrair e–, e esta será denominada potencial de redução (Ered).
1.1. Eletrodo
Um eletrodo (que em grego significa "caminho para a eletricidade") é formado por um metal, mergulhado numa solução contendo cátions desse metal.
Exemplo
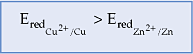
1.2. Condições para Condução da Corrente Elétrica
– Uma diferença de potencial (ddp);
– Um meio condutor.
Como o eletrodo de cobre (Cu2+/Cu) possui maior potencial de redução que o eletrodo de zinco (Zn2+/Zn), podemos dizer que entre os eletrodos existe uma ddp. Se entre esses eletrodos intercalarmos um fio condutor, agora teremos condições para condução da corrente elétrica.
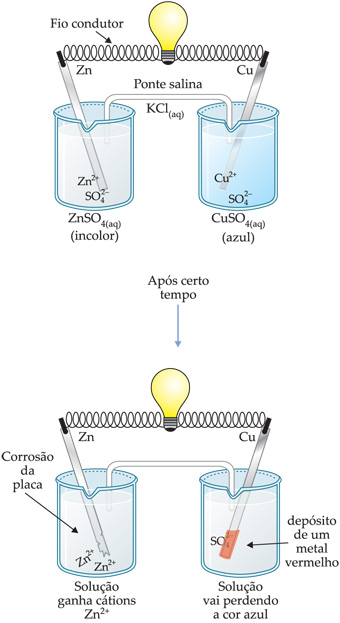
1.3. Pilha de Daniel
Experiência
Explicação
No eletrodo de cobre:
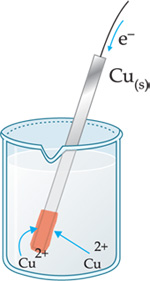
Íons
![]() da solução migram até a placa de cobre e recebem os elétrons cedidos
pelo Zn(s).
Ao receberem os elétrons, se transformam em Cu(s),
de acordo com a equação:
da solução migram até a placa de cobre e recebem os elétrons cedidos
pelo Zn(s).
Ao receberem os elétrons, se transformam em Cu(s),
de acordo com a equação:


No eletrodo de zinco:
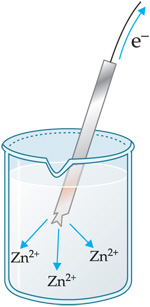
Ao ceder elétrons através do condutor metálico
para o íon
![]() ,
devido à ddp entre os dois eletrodos, Zn(s) da placa vai para
a solução na forma de
,
devido à ddp entre os dois eletrodos, Zn(s) da placa vai para
a solução na forma de
![]() ,
causando assim a corrosão da placa e conseqüente aumento da concentração de
,
causando assim a corrosão da placa e conseqüente aumento da concentração de
![]() na solução, de acordo com a equação:
na solução, de acordo com a equação:
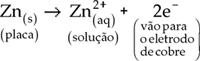
Assim, devido à ddp criada entre os dois eletrodos, observamos que existe um movimento ordenado de cargas no fio condutor, ou seja, uma corrente elétrica. Tal fato fica evidenciado pela lâmpada que acende quando a pilha é acionada.
Portanto, pilhas são sistemas que possuem capacidade de produzir energia elétrica a partir de uma reação química. Estes sistemas podem ser chamados também de células galvânicas. Uma célula galvânica, ou simplesmente pilha, transforma a energia de uma reação química em energia elétrica.
I. Ponte Salina
Para evitar a mistura das soluções, utiliza-se a ponte salina, que une os dois compartimentos do eletrodo e completa, o circuito elétrico. A ponte salina é formada por um gel contendo solução salina aquosa concentrada dentro de um tubo. A solução salina mais utilizada é o KCl, pois os íons K+ e Cl– não afetam as reações que ocorrem nas células.
À medida que a lâmina de zinco corrói, a solução do eletrodo de zinco vai
ganhando cátions
![]() (cargas positivas). Haverá no eletrodo excesso de cargas positivas.
(cargas positivas). Haverá no eletrodo excesso de cargas positivas.
À medida que a lâmina de cobre tem a sua massa aumentada, a solução do
eletrodo de cobre vai perdendo cátions
![]() (cargas positivas). Haverá no eletrodo excesso de cargas negativas
(cargas positivas). Haverá no eletrodo excesso de cargas negativas
![]() .
.
A função da ponte salina é manter o equilíbrio elétrico de cargas positivas e negativas nas soluções dos eletrodos. Assim, K+ migra da ponte para o eletrodo de cobre e Cl– migra para o eletrodo de zinco.
No condutor existe uma corrente de elétrons.
Na ponte salina existe uma corrente de íons.
Observação
Se entre as duas soluções é encontrada uma placa porosa, ao invés de
ponte salina, ocorre migração dos íons existentes nas soluções ,ou seja:
íons Zn2+ migram através da
placa para o eletrodo de Cu e íons
![]() migram para o eletrodo de Zn. Concluindo, podemos dizer que cátions migram
para o cátodo e ânions, para o ânodo.
migram para o eletrodo de Zn. Concluindo, podemos dizer que cátions migram
para o cátodo e ânions, para o ânodo.
II. Reação Global da Pilha

III. Nomenclatura dos Eletrodos
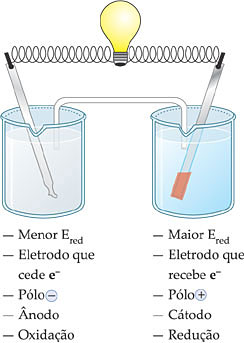
1.4. Esquema e Representação
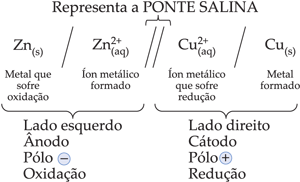
1.5. Medindo a ddp de uma pilha
Experiência: seja a pilha de Daniell, na qual intercalaremos no fio condutor um voltímetro (aparelho usado para medida da ddp).
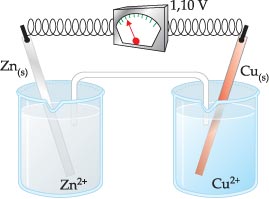
A ddp registrada para a pilha zinco-cobre é igual a 1,10 V, ou seja, a ddp entre os eletrodos de zinco e cobre é igual a 1,10 V.
Teoricamente a ddp é calculada da seguinte forma:
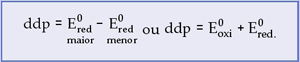
A medida do Ered absoluto de um eletrodo é impossível e, sendo assim, a equação acima possui duas incógnitas, já que o único valor obtido na prática é a ddp.
Não sendo possível medir o valor absoluto do Ered
de um eletrodo, iremos trabalhar com potenciais relativos, e para tanto
vamos escolher um eletrodo padrão. O escolhido foi o eletrodo de hidrogênio
ao qual se atribui o
![]() = zero.
= zero.
I. O Eletrodo de Hidrogênio (Padrão)
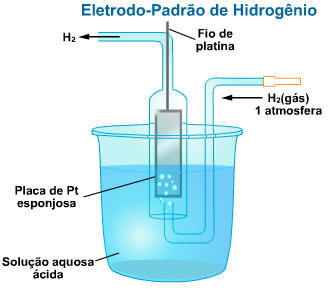
No interior de um tubo invertido é colocada uma lâmina de platina ligada a um fio também de platina. O sistema é mergulhado numa solução aquosa 1,0 M de H2SO4. Injeta-se na abertura lateral do tubo gás hidrogênio sob pressão de 1 atm, a 25 °C. Parte do gás hidrogênio adere à superfície da platina, fenômeno este chamado de adsorção.
O gás adsorvido na placa forma uma película de
H2 sobre a platina e o conjunto funciona como se fosse uma placa
de hidrogênio, mergulhada numa solução contendo cátions
![]() (eletrodo de hidrogênio).
(eletrodo de hidrogênio).
![]()
Reações no eletrodo de Hidrogênio:
– Perda de e-: H2(g)
![]() 2
2![]() + 2e– E0
= 0,00 V
+ 2e– E0
= 0,00 V
– Ganho de e–:
2![]() + 2e–
+ 2e–
![]() H2(g) E0
= 0,00 V
H2(g) E0
= 0,00 V
II. Medida de Potencial de Redução de um Eletrodo (Relativo)
Observe a experiência abaixo:
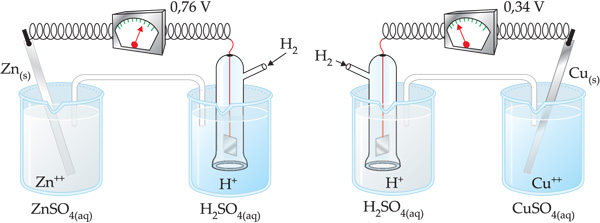
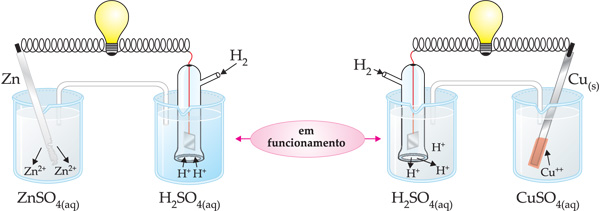
– No caso da pilha formada pelos eletrodos de zinco e hidrogênio, a ddp registrada foi de 0,76 V. Com o funcionamento da pilha, percebemos que no eletrodo de zinco ocorre corrosão do Zn(s), donde concluímos que este sofre oxidação.
Assim, o Ered do eletrodo de hidrogênio (Ered = zero) é maior que o do eletrodo de zinco.
Como:
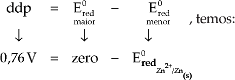
![]()
O sinal negativo indica que o eletrodo de hidrogênio ao qual foi atribuído um Ered = zero possui capacidade de atrair e– do eletrodo de zinco.

No caso da pilha formada pelos eletrodos de cobre e hidrogênio , a ddp
registrada foi de 0,34 V. Com o funcionamento da pilha, percebemos que no
eletrodo de cobre ocorreu deposição do metal na placa, donde concluímos que
houve redução do íon
![]() ,
como mostra a equação:
,
como mostra a equação:
Assim, o
![]() do eletrodo de hidrogênio (
do eletrodo de hidrogênio (![]() =
zero) é menor que o do eletrodo de cobre.
=
zero) é menor que o do eletrodo de cobre.
Como:
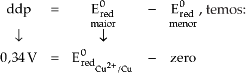
![]()
O sinal positivo indica que o eletrodo de cobre
possui um Ered maior que o do
eletrodo de hidrogênio, ou seja, o íon Cu2+
é capaz de oxidar o H2: H2
![]() 2H+ + 2e-
2H+ + 2e-
Como percebemos nos exemplos descritos, o
eletrodo de hidrogênio pode ser o cátodo ou o ânodo de uma pilha. Se
combinarmos o eletrodo de hidrogênio com eletrodos dos mais variados metais,
perceberemos que alguns se comportam como o eletrodo de cobre
![]() , já outros como o eletrodo de zinco
, já outros como o eletrodo de zinco
![]() .
.
Assim, experimentalmente, é possível construir
uma tabela de
![]() .
.
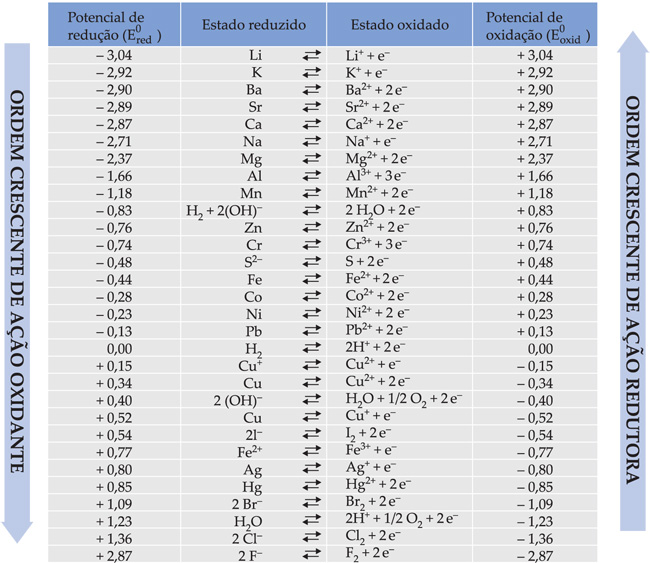
III. Tabela dos Ered
Potenciais de Redução (Ered) expressos em volts (Solução aquosa 1M a 25 °C e 1 atm)

IV. Cálculo da ddp de uma pilha
A ddp de uma pilha depende de dois fatores:
– da natureza da reação na pilha;
– das concentrações das espécies que participam da reação.
Vamos trabalhar somente com a natureza da reação, onde a ddp pode ser calculada da seguinte forma:

Para uma pilha, a ddp é positiva, o que reflete a espontaneidade da reação.
2. Espontaneidade das Reações de Oxirredução
Quanto maior o potencial de redução de um elemento, maior a tendência em ganhar elétrons. Portanto, ele recebe elétrons de um outro elemento de menor potencial de redução. Para o potencial de oxidação, quanto maior o valor de E0, maior a tendência em perder elétrons e, portanto, ceder elétrons para outro elemento de menor potencial de oxidação.
Por exemplo:
![]()
Dados:
Cu2+ + 2 e– → Cu° E = + 0,34 V
Zn2+ + 2 e– → Zn° E = – 0,76 V
Para sabermos se a reação é espontânea ou não, devemos adotar a seguinte conduta;
– verificar, no sentido indicado da reação, a espécie que sofre oxidação (perde e–) e a espécie que sofre redução (ganha e–);
– se a espécie que sofre redução apresentar um
![]() maior que o da espécie que sofre oxidação, a reação é espontânea; caso
contrário, não.
maior que o da espécie que sofre oxidação, a reação é espontânea; caso
contrário, não.
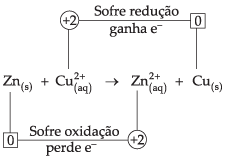
O fato de o íon Cu2+ apresentar um Ered maior significa que ele possui capacidade de atrair e– do Zn(s), e, sendo assim, a reação será espontânea.
Observação
– Objetos metálicos podem ser protegidos da corrosão de vários modos diferentes;
– aplicação de uma camada de tinta na superfície metálica;
– cobrir a superfície metálica com outro metal (eletrólise);
– colocar o metal a ser protegido em contato com outro metal que apresente um potencial de oxidação maior. Neste caso, o metal de maior potencial de oxidação sofre corrosão (oxidação), protegendo o metal de menor potencial de oxidação. Por exemplo, Mg e Zn são utilizados para a proteção do Fe contra a ferrugem. Mg e Zn são denominados metais de sacríficio.
Saiba mais sobre...

A corrosão dos metais, principalmente, o ferro
está bastante presente em nosso dia-a-dia, isso pode ser notado ao nosso
redor, nas latarias dos automóveis, nas cadeiras metálicas, nos portões e em
outras superfícies metálicas desprotegidas.
Um método de proteção, que é bastante utilizado é a pintura. A tinta, no
caso da pintura dos metais é uma película que fica entre a superfície do
metais e o ambiente, evitando assim, que se forme uma pilha eletroquímica
entre a superfície do metal e o ambiente.
Isso é possível?
É possível uma pilha entre um metal e o ambiente?
Sim, é possível e quanto mais próximo do litoral estiver, mais real se
tornará, pois a umidade presente no ar do litoral possui água do mar, que
possui íons (Na+ e Cl-, principalmente), servindo
assim de ponte salina da pilha eletroquímica.
Pode-se ver um exemplo de corrosão presente no nosso dia-a-dia,
considerando:
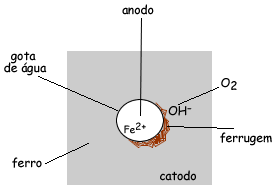
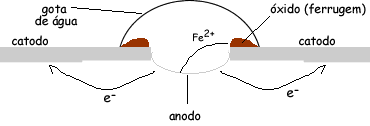
A partir destas figuras, temos que a superfície
do metal é o catodo e o centro da gota é o anodo. Onde a gota está presente
existirá a oxidação do ferro e a superfície reduzirá. Na verdade ocorrerá um
fluxo de elétrons saindo do anodo e se espalhando para toda superfície
metálica.
As reações ocorridas são:
anodo, ocorre a oxidação do ferro
Fe0 → Fe2+ + 2e-
(catodo, redução do oxigênio para formação da hidroxila, OH-, que participará da formação do óxido)
O2 + 2 H2O + 4e- → 4 OH-
Somando as semi-equações, temos:
2 Fe + O2 + 2 H2O → 2 Fe(OH)2
O Fe(OH)2 será oxidado à Fe(OH)3 pelo oxigênio atmosférico, pois o Fe3+ é mais estável do que o Fe2+.
Fe(OH)3 (ferrugem)
Quanto mais íons existirem na água
da gota, mais fácil ocorrerá a reação. Lembre-se da ponte salina.
É comum que o ferro seja recoberto por película de tinta (ou zarcão)
ou de outro metal, como estanho, zinco ou crômio, a fim de ser protegido
contra corrosão. A folha de aço usada nas latas para bebidas ou alimentos é
revestida por películas de estanho, seja pela imersão em estanho fundido,
seja por galvanoplastia. O estanho protege o ferro desde que a película seja
contínua.

Locomotiva recoberta por uma película de zarcão.
Outra maneira de proteção é associar ao ferro um metal que seja mais reativo do que ele, como o zinco ou o magnésio. Esse metal sofrerá oxidação antes do ferro, protegendo-o assim. Os dutos de óleo ou de gás que trabalham enterrados no solo são protegidos dessa forma (geralmente com anodo de sacrifício de magnésio). Bem como os motores de embarcações e cascos de navio (geralmente usando o zinco como metal de sacrifício).

Construção de um gasoduto com colocação do metal de sacrifício
As reações de eletroquímica não ocorrem somente com metais, mas também
ocorrem nos processos de oxidação de alimentos, entre tantos outros, sendo a
eletroquímica bastante abrangente.
Consiste em uma reação de oxirredução não espontânea. É o inverso de uma pilha. Na eletrólise há a necessidade de uma fonte externa de corrente elétrica (contínua) para que uma reação não espontânea ocorra.
O recipiente em que se realiza a eletrólise recebe o nome de célula eletrolítica ou cuba eletrolítica.
O eletrólito, ou substância que conduz eletricidade, deve ser um composto iônico líquido (fundido), ou então em solução. Pode ser um composto molecular, desde que este se ionize quando em solução. Como exemplo temos os ácidos.
3.1. Como Funciona a Eletrólise
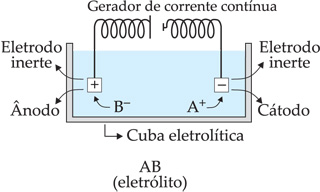
Os íons negativos são atraídos pelo pólo
![]() (ânodo), onde irão perder elétrons (oxidação). Os elétrons cedidos ao pólo
(ânodo), onde irão perder elétrons (oxidação). Os elétrons cedidos ao pólo
![]() migram através do circuito externo até o pólo
migram através do circuito externo até o pólo
![]() (cátodo). Lá, estes serão "ganhos" pelos íons positivos (redução).
(cátodo). Lá, estes serão "ganhos" pelos íons positivos (redução).

![]()

3.2. Eletrólise Ígnea
Como já vimos anteriormente, para que ocorra uma eletrólise é necessária a presença de íons livres. Um composto iônico, no estado sólido, não deve sofrer eletrólise, já que não possui íons livres. Uma forma de liberar os íons deste composto é aquecê-los até a fusão (fundir). A eletrólise que ocorre, nessas condições, é chamada eletrólise ígnea (do latim igneus = inflamado, ardente).
Exemplo
Eletrólise ígnea do NaCl:
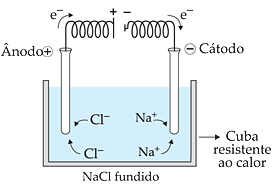
![]()
Semi-reações da eletrólise ígnea do NaCl:
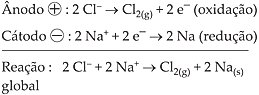
Observação
– Normalmente os eletrodos utilizados são de grafite.
- O número de elétrons libertados no ânodo é sempre igual ao número de elétrons absorvidos no cátodo, em qualquer instante da eletrólise.
3.3. Eletrólise em Soluções Aquosas
Quando um eletrólito é dissolvido em água (havendo ionização ou dissociação do mesmo), além dos seus íons, devemos considerar a ionização da própria água.
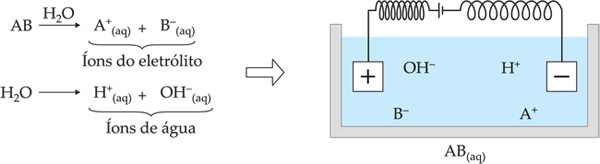
Observação– Embora a ionização da água ocorra em pequena escala (1 molécula se ioniza em cada 555 milhões de moléculas), seus íons devem ser considerados.
Experimentalmente, observa-se que, na eletrólise aquosa, apenas um tipo de cátion é atraído por vez no cátodo, e, enquanto ele estiver presente na solução, nenhuma outra espécie será atraída. O mesmo ocorre em relação aos ânions no ânodo.
Exemplo
Suponhamos uma solução aquosa de AB. Os íons presentes na solução serão:
![]() e
e
![]() provenientes do eletrólito AB
provenientes do eletrólito AB
![]() e
e
![]() provenientes da água
provenientes da água
Consultando a tabela de
![]() ,
se verificarmos que o
,
se verificarmos que o
![]() possui maior
possui maior
![]() que o
que o
![]() (hipotético), o
(hipotético), o
![]() vai se reduzir mais facilmente. Assim, a reação que ocorre, neste caso, é a
descarga do
vai se reduzir mais facilmente. Assim, a reação que ocorre, neste caso, é a
descarga do
![]() e não a do
e não a do
![]() .
.
No caso dos ânions em solução, podemos dizer que, quanto maior a eletronegatividade do ânion, maior será sua tendência de atrair os elétrons e, portanto, mais difícil será doá-los. Suponha, no exemplo anterior, que B– seja menos eletronegativo que OH–. Logo, B– perderá elétrons mais facilmente (descarrega primeiro).
A seguir, mostramos a ordem crescente de facilidade de descarga para cátions e ânions.
Cátions: IA+, IIA2+, Al3+, H+, cátions restantes (atraídos pelo pólo –).

Ânions: F–,
ânions oxigenados,
![]() ,
OH –,
,
OH –,
![]()
Resumo
De um modo geral podemos afirmar que as reações que ocorrem em cada eletrodo podem ser representadas resumidamente por:
Pólo negativo - Cátodo - Redução
Metais: MX+(aq) + X e- → M0(s) (Exceto: Hg(ℓ))
Ácidos: 2 H+(aq) + 2 e- → H2(g)
Água: 2 H2O(ℓ) + 2 e- → H2(g) + 2 OH-(aq)
Pólo positivo - Ânodo - Oxidação
Halogênios: 2 X-(aq) → X2 + 2 e- (X2 = F2(g), Cℓ2(g), I2(s), Br2(ℓ))
Bases: 2 OH-(aq) → H2O(ℓ) + 1/2 O2(g) + 2 e-
Água: H2O(ℓ) → 1/2 O2(g) + 2H+(aq) + 2 e-
3.4. Estequiometria da Eletrólise
Cada elétron que atravessa o circuito transporta uma carga de 1,6·10–19 C. Se x elétrons atravessam o circuito, eles transportarão uma carga de x·1,6·10–19 C. Assim, para um mol de elétrons, teremos:
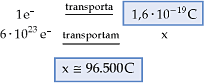
Conclusão
Quando 1 mol de elétrons atravessa um circuito, transporta a carga de 96.500 C.
Esta carga é denominada 1 Faraday.
![]()
Desta forma:
![]()
A carga Q (coulombs) que atravessa o circuito pode ser calculada, multiplicando a corrente (ampères) pelo tempo (segundos).
![]()
Este site foi atualizado em 04/03/19