 EQUILÍBRIO
QUÍMICO
EQUILÍBRIO
QUÍMICO
Sistema em equilíbrio: 2NO2(g) castanho
![]() N2O4(g) laranja
N2O4(g) laranja
ÍNDICE
Ocorre quando, em uma reação reversível, a velocidade da reação direta é igual à velocidade da reação inversa. Uma vez atingido o estado de equilíbrio, as concentrações de reagentes e produtos permanecem constantes. Consideremos a equação genérica:
![]()
onde:
- v1 é a velocidade da reação direta e v2 a velocidade da reação inversa.
No início v1 é o máximo porque as concentrações de A e B apresentam valores máximos, enquanto que v2 é igual a zero, porque C e D ainda não foram formados. À medida que a reação ocorre, A e B diminuem, e C e D aumentam, portanto v1 diminui e v2 aumenta, até que as duas velocidades se igualem. No instante em que v1 = v2, podemos dizer que o sistema atinge o estado de equilíbrio.
Atingido o estado de equilíbrio, a reação química continua a ocorrer (nível microscópico) nos dois sentidos, com a mesma velocidade e, portanto, as concentrações de reagentes e produtos ficam constantes. Por isso, podemos dizer que o equilíbrio é um equilíbrio dinâmico.
Ao considerarmos o sistema como um todo (nível macroscópico), aparentemente a reação “parou” de acontecer, porque as concentrações de reagentes e produtos permanecem inalterados indefinidamente.
Para que o estado de equilíbrio possa ser atingido, é necessário que:
– o sistema encontre-se num recipiente fechado;
– a temperatura fique constante.
Graficamente, podemos representar:
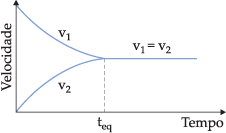
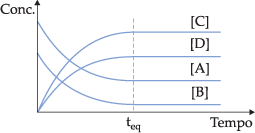
Os equilíbrios químicos podem ser classificados em homogêneos e heterogêneos.
2.1. Equilíbrio Homogêneo
É aquele em que todos os participantes se encontram numa única fase. Portanto, classificamos o sistema como sendo homogêneo.H2(g) + I2(g)
![]() 2HI(g)
2HI(g)
HCN(aq)
![]() H+(aq) + CN-(aq)
H+(aq) + CN-(aq)
2.2. Equilíbrio Heterogêneo
É aquele em que os participantes se encontram em mais de uma fase. Portanto, classificamos o sistema como sendo heterogêneo.
C(s) + O2(g)
![]() CO2(g)
CO2(g)
Indica a porcentagem em mols de uma determinada espécie que reagiu para estabelecer o equilíbrio. Podemos representar:
![]()
Exemplo
Consideramos a reação x → y + z, em que, no início, encontramos 2,00 mols de x e no equilíbrio são encontrados 0,80 mols de x sem reagir. Concluímos, então, que reagiu 2,00 – 0,80 = 1,20 mols de x. O grau de equilíbrio fica:
![]()
Concluindo, podemos dizer que quanto maior o valor de α no equilíbrio, encontramos menor sobra de reagentes em maior quantidade de produtos. Quanto menor o valor de α no equilíbrio, encontramos muita sobra de reagentes e pouco produto.
4. Constante de Equilíbrio em Termos das Concentrações Molares (Kc)
Dada uma reação reversível qualquer:
aA + bB
![]() cC + dD
cC + dD
Aplicando-se a lei da ação das massas de Guldberg-Waage, temos:
• para a reação direta:
v1 = K1 · [A]a · [B]b
• para a reação inversa:
v2 = K2 · [C]c · [D]d
No equilíbrio: v1 = v2
K1 · [A]a · [B]b = K2 · [C]c · [D]d
![]()
A relação
![]() é constante e denomina-se constante de equilíbrio em termos de concentração
molar (Kc):
é constante e denomina-se constante de equilíbrio em termos de concentração
molar (Kc):
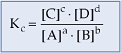
A constante de equilíbrio Kc é, portanto, a razão das concentrações dos produtos da reação e das concentrações dos reagentes da reação, todas elevadas a expoentes que correspondem aos coeficientes da reação.
Observações
a) A constante de equilíbrio Kc varia com a temperatura;
b) Quanto maior o valor de Kc , maior o rendimento da reação, já que no numerador temos os produtos e no denominador os reagentes. Portanto, comparando valores de Kc em duas temperaturas diferentes, podemos saber em qual destas a reação direta apresenta maior rendimento;
c) O valor numérico de Kc depende de como é escrita a equação química.
Por exemplo:
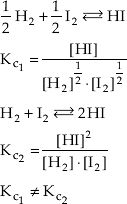
Por este motivo devemos escrever sempre a equação química junto com o valor de Kc.
d) A constante de equilíbrio é adimensional, ou seja, não possui unidade.
5. Constante de Equilíbrio em Termos das Pressões Parciais (Kp)
Quando os componentes do equilíbrio são substâncias gasosas, além da constante Kc, podemos expressar a constante de equilíbrio em termos de pressões parciais (Kp).
Assim para a reação:
aA(g) + bB(g)
![]() cC(g) + dD(g)
cC(g) + dD(g)
a constante de equilíbrio pode ser:
![]() constante
de equilíbrio em termos de concentração molar Kc
constante
de equilíbrio em termos de concentração molar Kc
ou
![]() constante
de equilíbrio em termos de pressões parciais Kp
constante
de equilíbrio em termos de pressões parciais Kp
Portanto, concluímos que Kp é a razão entre o produto das pressões parciais dos produtos gasosos e o produto das pressões parciais dos reagentes gasosos, estando todas as pressões elevadas a expoentes iguais aos respectivos coeficientes, na equação química balanceada.
Por exemplo:
H2(g) + I2(g)
![]() 2HI(g)
2HI(g)
![]()
Observação
Para equilíbrio em sistema heterogêneo, o estado sólido não participa das expressões Kp e Kc, o estado líquido participa somente de Kc, e o estado gasoso participa das duas expressões.
Exemplos
a) CaCO3 (s)
![]() CaO(s) + CO2 (g)
CaO(s) + CO2 (g)
Kc = [CO2]
Kp = pCO2
b)
![]()
![]()
Kp = pH2
c)
![]()
![]()
Kp não é definido, pois não encontramos substância no estado gasoso.
As constantes de equilíbrio Kc e Kp podem ser relacionadas da seguinte forma:
Kp = Kc
· (R · T)![]()
Onde:
![]() n
→variação da quantidade em mols (diferença entre a
quantidade em mols dos produtos e reagentes).
n
→variação da quantidade em mols (diferença entre a
quantidade em mols dos produtos e reagentes).
Kc → constante de equilíbrio em termos de concentração molar.
KP → constante de equilíbrio em termos das pressões parciais.
T → temperatura absoluta.
R → constante dos gases.
Valores Usuais da Constante R

Já sabemos que toda reação química reversível tende a um equilíbrio em que as velocidades da reação direta e inversa são iguais:
Reagentes
![]() Produtos
Produtos
onde: V1=V2
Em conseqüência, as concentrações de cada substância presente no equilíbrio permanecem inalteradas. Qualquer fator que altere esta condição (v1 = v2) desequilibra a reação, até se atingir um novo equilíbrio, no qual as concentrações dos reagentes e produtos se modificaram em relação aos valores originais.
Em resumo, podemos dizer que deslocar o equilíbrio significa provocar diferença nas velocidades das reações direta e inversa, e, conseqüentemente, modificações nas concentrações das substâncias, até que um novo estado de equilíbrio seja atingido.
Se, no novo equilíbrio, a concentração dos produtos for maior que a concentração original, dizemos que houve deslocamento para a direita (sentido de formação dos produtos), já que v1 foi maior que v2:
Reagentes
![]() Produtos
Produtos
No entanto, se a concentração dos reagentes for maior do que na situação anterior de equilíbrio, dizemos que houve deslocamento para a esquerda (sentido de formação dos reagentes), já que v2 foi maior que v1:
Reagentes
![]() Produtos
Produtos
Em 1884, Le Chatelier enunciou o princípio geral que trata dos deslocamentos dos estados de equilíbrio, que ficou conhecido como Princípio de Le Chatelier.
“Quando uma força externa age sobre um sistema em equilíbrio, este se desloca, procurando anular a ação da força aplicada.”
As forças capazes de deslocar o equilíbrio químico são:
a) pressão sobre o sistema;
b) temperatura;
c) concentração dos reagentes ou produtos.
7.1. Concentração dos Participantes do Equilíbrio
Um aumento na concentração de qualquer substância (reagentes ou produtos) desloca o equilíbrio no sentido de consumir a substância adicionada. O aumento na concentração provoca aumento na velocidade, fazendo com que a reação ocorra em maior escala no sentido direto ou inverso.
Diminuindo a concentração de qualquer substância (reagentes ou produtos) desloca-se o equilíbrio no sentido de refazer a substância retirada. A diminuição na concentração provoca uma queda na velocidade da reação direta ou inversa, fazendo com que a reação ocorra em menor escala nesse sentido.
Exemplos
1o) 2 CO(g) + O2(g)
![]() 2 CO(g)
2 CO(g)
O aumento na concentração de CO ou O2 provoca aumento em v1, fazendo com que v1 > v2; portanto, o equilíbrio desloca-se para a direita.
A diminuição na concentração de CO ou O2 provoca queda em v1, fazendo com que v1 < v2; portanto, o equilíbrio desloca-se para a esquerda.
2o) C(s) + CO2(g)
![]() 2 CO(g)
2 CO(g)
Para equilíbrio em sistema heterogêneo, a adição de sólido (C(s)) não altera o estado de equilíbrio, pois a concentração do sólido é constante e não depende da quantidade.
Observação
Tudo o que foi discutido para a concentração também é válido para as pressões parciais em sistemas gasosos.
Por exemplo: H2(g) + I2(g)
![]() 2 HI(g)
2 HI(g)
- Aumento na pressão parcial de H2 ou I2, o equilíbrio desloca-se para a direita.
- Diminuindo a pressão parcial de H2 ou I2, o equilíbrio desloca-se para a esquerda.
7.2. Pressão Total sobre o Sistema
Um aumento na pressão desloca o equilíbrio no sentido do menor volume gasoso.
Uma diminuição na pressão desloca o equilíbrio no sentido do maior volume gasoso.
Exemplo:
![]()
• Aumento de pressão desloca o equilíbrio para a direita (menor volume).
• Diminuindo a pressão, desloca-se o equilíbrio para a esquerda (maior volume).
Existem equilíbrios que não são afetados pela pressão:
• não é observada variação de volume:
![]()
• não encontramos reagentes e nem produto no estado gasoso
CH3 – COOH(l) + CH3
– CH2OH(l)
![]() CH3COOC2H5(l)
+ H2O(l)
CH3COOC2H5(l)
+ H2O(l)
7.3. Temperatura
Um aumento na temperatura desloca o equilíbrio no sentido endotérmico. Uma diminuição na temperatura desloca o equilíbrio no sentido exotérmico.
Exemplo:
N2 + 3 H2
![]() 2 NH3 ΔH
= – 26,2 kcal
2 NH3 ΔH
= – 26,2 kcal
• Um aumento na temperatura desloca o equilíbrio para a esquerda (endotérmico).
• Diminuindo a temperatura, desloca-se o equilíbrio para a direita (exotérmico).
A temperatura é o único fator que desloca o equilíbrio e altera o valor da constante de equilíbrio. Por exemplo , um aumento na temperatura provoca aumento do valor da constante de equilíbrio para reações endotérmicas (ΔH >0) e diminuição para exotérmicas (ΔH < 0).
Observação
O catalisador não desloca o equilíbrio porque aumenta a velocidade da reação direta e inversa na mesma proporção. O catalisador apenas diminui o tempo necessário para que o estado de equilíbrio seja atingido.
Considere o eletrólito AB em solução aquosa:
AB
![]() A+ + B–
A+ + B–
Sua ionização (se AB for molecular) ou sua dissociação (se AB for iônico) também é um fenômeno reversível e, assim sendo, atingirá, após determinado tempo, o equilíbrio químico. Este equilíbrio será agora chamado de equilíbrio iônico porque aparecem íons. Importante ressaltar que, no caso de bases fortes e sais solúveis, não podemos falar em equilíbrio iônico, já que a reação inversa não se processa (a dissociação não é reversível).
Exemplos
![]()
![]()
![]() (não reversível)
(não reversível)
![]() (não reversível)
(não reversível)
Se considerarmos a ionização do HNO2:
![]()
A exemplo de equilíbrios anteriores, podemos escrever que sua constante de equilíbrio é:
![]()
Esta constante de equilíbrio, Kc, recebe agora o nome particular de constante de ionização ou constante de dissociação iônica e é representada por Ki, Ka (no caso de ácidos) ou Kb (no caso de bases).
![]()
![]()
![]()
![]()
Observações
a) Ki varia com a temperatura.
b) Quando a ionização de um eletrólito apresentar várias etapas, temos para cada etapa uma constante de ionização:
![]()
![]()
![]()
Observe que a primeira constante de ionização de ácido fosfórico é maior que a segunda, que, por sua vez, é maior que a terceira, indicando que a primeira ionização de um eletrólito ocorre mais intensamente que as outras subseqüentes.
c) Valores altos de Ki indicam eletrólitos fortes que são, portanto, muito dissociados ou ionizados; enquanto valores baixos indicam que o eletrólito é fraco.
Na tabela seguinte, temos valores de Ka de alguns ácidos:
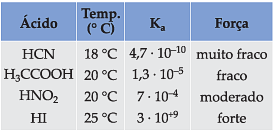
Chamamos
![]() o grau de ionização de um eletrólito, que pode ser definido como a fração do
mol que está ionizada na solução. Portanto, para cada mol que foi
inicialmente dissolvido, a representa a parte que se ionizou. De forma
geral, temos:
o grau de ionização de um eletrólito, que pode ser definido como a fração do
mol que está ionizada na solução. Portanto, para cada mol que foi
inicialmente dissolvido, a representa a parte que se ionizou. De forma
geral, temos:
![]()
Considere o equilíbrio: AB
![]() A+ + B–
A+ + B–
A partir da concentração molar (![]() )
e do grau de ionização (α), podemos
relacionar Ki e α:
)
e do grau de ionização (α), podemos
relacionar Ki e α:

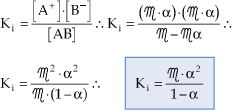
Esta fórmula é a Lei da Diluição de Ostwald e permite concluir que, quanto menor a concentração de um eletrólito, maior será seu grau de ionização, o que significa dizer que o grau de ionização aumenta à medida que se dilui a solução.
Para eletrólitos fracos, nos quais os valores de α são muito pequenos, podemos considerar 1 – α como sendo praticamente 1, o que simplifica a equação de Ostwald para:
![]()
Efeito do íon comum é o nome que se dá à aplicação do princípio de Le Chatelier (deslocamento do equilíbrio) para equilíbrios iônicos.
Exemplo
Considere o equilíbrio que se estabelece quando HCN é colocado em água:
HCN
![]() H+ + CN–
H+ + CN–
Vamos supor agora que se adicione à solução cianeto de sódio (NaCN). Como NaCN é iônico, sua dissociação é total:
NaCN → Na+ + CN–
O íon CN– oriundo do cianeto de sódio é comum ao equilíbrio do ácido; logo, sua concentração aumentará, o que provocará o deslocamento do equilíbrio para a esquerda, no sentido de formar HCN, diminuindo, portanto, a ionização do ácido.
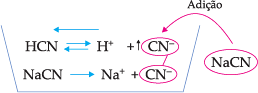
O fato de o grau de ionização de um eletrólito diminuir pela adição, na solução, de outro eletrólito que possua um íon igual a um dos íons do 1o eletrólito recebe o nome de efeito de íon comum.
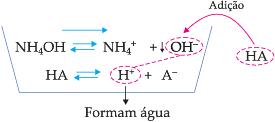
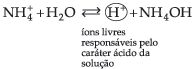
É importante lembrar que há íons que, apesar de não serem comuns ao equilíbrio iônico, também podem deslocá-lo. Tomemos, por exemplo, a dissociação de NH4OH:
![]()
Se a esta solução adicionarmos um ácido qualquer, estaremos adicionando H+, que reagirá com os íons OH– da base, formando água.
A concentração de íons OH– irá diminuir e, portanto, o equilíbrio será deslocado para a direita, aumentando a dissociação da base.
Indicadores ácido-base são substâncias químicas, geralmente ácidos ou bases fracas, que mudam de cor, dependendo de o meio estar ácido ou básico.
Esta mudança de cor é decorrência do deslocamento do equilíbrio químico. Tomemos, por exemplo, o indicador ácido-base genérico HIn:
![]()
Se adicionarmos ao equilíbrio um ácido qualquer, haverá um aumento na concentração de íons H+, o que provoca um deslocamento para a esquerda, fazendo com que a solução se torne amarela. No entanto, se adicionarmos uma base, há uma diminuição dos íons H+ (que são captados pelo OH– da base formando água) e, portanto, o equilíbrio se desloca para a direita, tornando a solução vermelha.
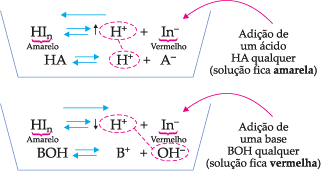
12. Equilíbrio Iônico da Água (Kw)
A água é um eletrólito extremamente fraco, que se ioniza segundo a equação:
H2O + H2O
![]() H3O+ + OH–
H3O+ + OH–
Ou simplesmente:
H2O
![]() H+ + OH–
H+ + OH–
Como toda ionização, a da água também atinge um equilíbrio, chamado equilíbrio iônico da água. Um litro de água a 25 ºC tem massa igual a 1.000 g. Portanto, em 1 litro, temos aproximadamente 55,5 mols de água:
![]()
Destes 55,5 mols, constata-se experimentalmente que apenas 10–7 mols sofrem ionização.
A constante de ionização da água pode ser deter-minada pela equação:
![]()
No entanto, a 25 ºC, a quantidade de água que fica sem se ionizar assume o valor de (55,5 – 10–7) mols/L, que é praticamente o valor inicial de 55,5 mols/L. Podemos então concluir que a concentração de água ([H2O]) é praticamente constante e, portanto,
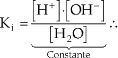

![]()
O produto iônico da água, Kw, tem valor igual a 10–14 a 25 ºC. Kw é uma constante de equilíbrio e como tal não é afetada pela variação na concentração de H+ ou OH–, mas varia com a temperatura.
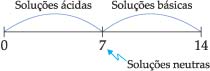
– Para soluções ácidas: [H+] > [OH-]
– Para soluções básicas: [H+] < [OH-]
– Para soluções neutras (ou água pura): [H+] = [OH-]
A 25 °C podemos afirmar que:
Soluções ácidas
[H+] > 10-7 mol/L
[OH-] < 10-7 mol/L
Soluções Básicas ou alcalinas
[H+] < 10-7 mol/L
[OH-] > 10-7 mol/L
Soluções neutras
[H+] = [OH-]
Para não se trabalhar com potências negativas,
como, por exemplo,
![]() Peter L. Sörensen propôs uma nova escala para as medidas de acidez e
basicidade das soluções, utilizando logaritmo segundo as definições:
Peter L. Sörensen propôs uma nova escala para as medidas de acidez e
basicidade das soluções, utilizando logaritmo segundo as definições:
![]()
![]()
A letra p, minúscula, significa potencial; portanto:
– pH é o potencial hidrogeniônico da solução;
– pOH é o potencial hidroxiliônico da solução.
13.1. Para soluções ácidas
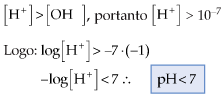
Exemplo
Qual o pH de uma solução de concentração hidrogeniônica igual a 10–5 ?
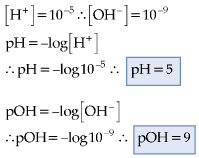
13.2. Para Soluções Básicas
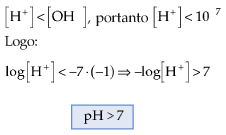
Exemplo
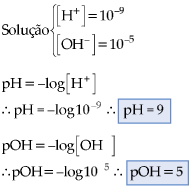
Portanto, a 25°C:
13.4. Relação entre pH e pOH
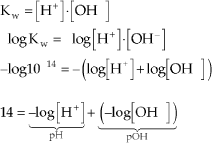
Portanto:
![]()
Chamamos hidrólise salina a reação entre um sal e a água, produzindo o ácido e a base correspondentes. A hidrólise do sal é, portanto, a reação inversa da neutralização.

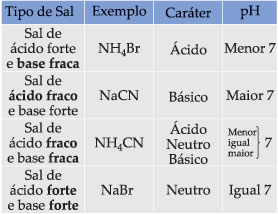
Para simplificar a análise dos fenômenos da hidrólise salina, os sais são divididos em 4 tipos, a saber:
1) Sal de ácido forte e base fraca;
2) Sal de ácido fraco e base forte;
3) Sal de ácido fraco e base fraca;
4) Sal de ácido forte e base forte.
14.1. Sal de Ácido Forte e Base Fraca
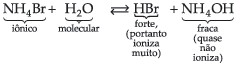
então ficamos com:
![]()
Podemos então observar que quem sofre a hidrólise não é o sal, mas sim o íon NH4+ (da base fraca), liberando íons H+, que conferem à solução caráter ácido com pH menor que 7.
14.2. Sal de Ácido Fraco e Base Forte
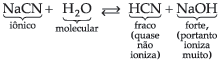
então ficamos com:
![]()

Observamos, então, que quem sofre a hidrólise, neste caso, é o íon CN– (do ácido fraco), liberando íons OH– que conferem à solução caráter básico com pH maior que 7.
14.3. Sal de Ácido Fraco e Base Fraca
![]()
então ficamos com:
![]()
Como tanto o ácido quanto a base são fracos, ocorre realmente a hidrólise do sal e não apenas de um dos íons (como nos dois casos anteriores). Podemos concluir que quem sofre hidrólise são os íons correspondentes ao ácido e/ou base fracos.
Neste caso, o meio pode ficar ácido, básico ou neutro.
• O meio será ligeiramente ácido se a ionização do ácido for maior que a da base (Ka > Kb);
• O meio será ligeiramente básico se a ionização do ácido for menor que a da base (Ka < Kb).
• O meio será neutro se a ionização do
ácido apresentar mesma intensidade que a da base (Ka
![]() Kb).
Kb).
14.4. Sal de Ácido Forte e Base Forte
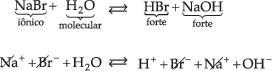
então ficamos com:
![]()
Sendo o NaOH uma base forte, os íons Na+ não captam os íons OH– da água. Do mesmo modo, sendo o HBr um ácido forte, os íons Br– não captam os íons H+ da água. Portanto, neste caso, não há hidrólise. A solução terá caráter neutro, com pH igual a 7.
Concluímos que, na solução salina, predomina sempre o caráter do mais forte. Quando o sal é formado por ácido/base de mesma força (2 fortes), a solução final é neutra.
14.5. Grau de Hidrólise (αh)
Define-se o grau de hidrólise (![]() )
de um sal como:
)
de um sal como:

A variação de αh é:
0 < αh < 1 ou 0% < αh < 100%
14.6. Constante de Hidrólise (Kh)
Para os equilíbrios químicos das reações de hidrólise, define-se uma constante de equilíbrio chamada constante de hidrólise (Kh).
Dado o equilíbrio de hidrólise:
![]()
A constante de hidrólise será:
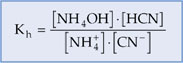
Observação:
A água não entra na expressão porque é o solvente e sua concentração molar é praticamente constante.
Generalizando:
![]()
onde p e r são os coeficientes da equação.
Lembre-se: a água não entra na expressão e a Kh é obtida sempre a partir da equação iônica de hidrólise.
14.7. Relação entre Kh e Ka e/ou Kb
Considerando a expressão da constante de hidrólise dada anteriormente como exemplo:
![]()
Se multiplicarmos simultaneamente o numerador e o denominador da fração por [H3O+] · [OH–], teremos:
![]()
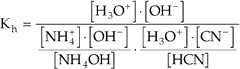
Como:
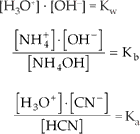
Com isso ficamos com:
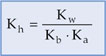
De modo análogo, obteremos:
a) para sal de ácido fraco e base forte:
![]()
b) para sal de ácido forte e base fraca:
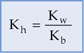
15. Produto de Solubilidade (PS ou KPS)
Existem substâncias pouco solúveis em água como, por exemplo, BaSO4. Adicionando certa quantidade de sulfato de bário à água, notamos que grande parte vai ao fundo, formando um precipitado constituído de BaSO4 que não se dissolve.
Entretanto, sabemos que a dissolução do sal não terminou. Na verdade, o sal continua a se dissolver, bem como a precipitar, estabelecendo um equilíbrio dinâmico. Este equilíbrio é chamado heterogêneo ou polifásico porque é o equilíbrio que se estabelece num sistema heterogêneo.
15.1. Constante do Produto de Solubilidade (PS ou KPS ou KS)
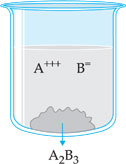
Suponha uma solução do eletrólito A2B3, pouco solúvel, em presença de seu corpo de chão (parte insolúvel). A parte que se dissolveu está sob a forma de íons A+++ e B=, enquanto a parte não-solúvel está na forma não-ionizada A2B3. Existe, assim, um equilíbrio dinâmico entre A2B3 e seus íons na solução, que pode ser representada pela equação:
![]()
Como todo equilíbrio, este também deve obedecer à lei:
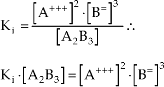
Como a concentração de um sólido tem valor constante, o produto Ki · [A2B3] da fórmula acima também é constante e é chamado de produto de solubilidade.
KPS = [A3+]2 . [B2-]3
Portanto, o produto de solubilidade (Kps ou PS) é o produto das concentrações molares dos íons existentes em uma solução saturada, onde cada concentração é elevada a um expoente igual ao respectivo coeficiente do íon na correspondente equação de dissociação.
Exemplos:
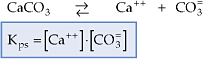
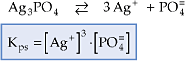

A expressão do Kps é utilizada somente para soluções saturadas de eletrólitos considerados insolúveis, porque a concentração de íons em solução é pequena, resultando soluções diluídas.
O Kps é uma grandeza que só depende da temperatura. Quanto mais solúvel o eletrólito, maior a concentração de íons em solução, maior o valor de Kps; quanto menos solúvel o eletrólito, menor a concentração de íons em solução, menor o valor de Kps, desde que as substâncias comparadas apresentem a mesma proporção entre os íons.
Exemplo
![]()
![]()
Como apresentam a mesma proporção em íons (1 : 1), o CaCO3 é mais solúvel que o BaCO3, porque possui maior valor de Kps.
Quando as substâncias comparadas possuem proporção em íons diferentes, a mais solúvel é aquela que apresenta maior solubilidade.
Exemplo
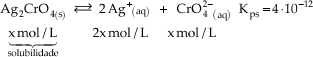
Kps = [Ag+]2 · [CrO42-]
4·10 –12 = (2x)2 · x
4·10 –12 = 4x3
X = 1,0.10-4 mol/L
solubilidade do Ag2CrO4, portanto, em 1 L de solução é possível dissolver até 10–4 mol de Ag2CrO4.
BaSO4(s)
![]() Ba2+(aq) + SO42-(aq)
KPS=1,0 . 10-10
Ba2+(aq) + SO42-(aq)
KPS=1,0 . 10-10
Y mol/L Y mol/L Y mol/L
KPS=[Ba2+].[SO42-]
10-10=(Y).(Y)
Y=1,0.10-5 mol/L
solubilidade do BaSO4 portanto, em 1 L de solução é possível dissolver até 10–5 mol de BaSO4.
Com isso concluímos que Ag2CrO4 é mais solúvel que o BaSO4.
15.2. Efeito do Íon Comum
A adição de íon comum ao equilíbrio provoca um deslocamento no equilíbrio para a esquerda, diminuindo a solubilidade do eletrólito.
Consideremos inicialmente uma solução saturada do eletrólito AB, sem a presença do corpo de fundo:
AB(s)
![]() A+(aq) + B–(aq)
A+(aq) + B–(aq)
A adição de íons A+ ou B– irá deslocar o equilíbrio no sentido de diminuir a concentração dos íons, até que estas concentrações satisfaçam os Kps. Portanto, ocorre a formação de precipitado.
Na presença de precipitado, a adição do íon comum desloca o equilíbrio no sentido de formação do eletrólito sólido, de modo a manter constante o produto das concentrações dos íons.
A adição do eletrólito sólido não altera o equilíbrio nem o número de íons em solução.
15.3. Previsão de Precipitação
Quando misturamos dois eletrólitos diferentes, em solução, é possível saber quando o precipitado começará a se formar, a partir de dois íons desses eletrólitos.
Por exemplo: São misturados volumes iguais de Pb(NO3)2 0,2 M e KI 0,2 M. Haverá formação de um precipitado de PbI2.
Dado: Kps do PbI2 = 1,4 · 10–8
Para respondermos a pergunta, primeiro encontramos a concentração de cada íon em solução:
Solução
![]()
![]()
Quando as duas soluções são misturadas, o volume da solução final duplica, portanto as concentrações de Pb2+ e I – caem pela metade.
A equação iônica que representa a precipitação fica:
Pb2+(aq) + 2l –(aq) → PbI2(s)
Sendo que o seu inverso representa a dissolução do PbI2 . Ao atingir o equilíbrio temos:
PbI2(s)
![]() Pb2+(aq) + 2I–(aq)
Pb2+(aq) + 2I–(aq)
Qps é denominado de quociente da reação, sendo calculado em função da concentração de íons que são misturados. A precipitação ocorre quando Qps é maior ou igual ao Kps. Em nosso caso, encontramos:
Qps = [Pb2+] · [i–]2
Qps = (0,1) · (0,1)2
Qps = 1,0 · 10–3
Como Kps = 1,4 · 10–8 concluímos que Qps > Kps, portanto ocorre precipitação.
Este site foi atualizado em 04/03/19
