 Termoquímica
Termoquímica

O fogo é proveniente de uma reação de combustão que libera grande quantidade de calor.

Roupas secando: processo físico, onde a água absorve calor do sol e evapora, secando as roupas.
ÍNDICE
| ENTALPIA | |
| TIPOS DE REAÇÕES | |
| DIAGRAMA DE ENTALPIA | |
| FATORES QUE ALTERAM O ΔH | |
| ESTADO PADRÃO | |
| EQUAÇÃO TERMOQUÍMICA | |
| CALOR DA REAÇÃO | |
| LEI DE HESS |
Uma das conseqüências do progresso da humanidade é o aumento no consumo da energia, pois não imaginamos civilização moderna sem indústrias, automóveis, aviões, fogões, geladeiras, etc.
A grande fonte de nossos recursos energéticos são, sem dúvida, as reações químicas, já que durante a ocorrência destas, há perda ou ganho de energia. Essas variações energéticas são freqüentemente expressas na forma de calor e serão estudadas na Termoquímica.
Termoquímica é a parte da Química que estuda as quantidades de calor liberadas ou absorvidas durante as reações químicas.
Os calores liberados ou absorvidos pelas reações são expressos em Joule (J), ou caloria (cal).
Uma caloria é a quantidade de calor necessária pa-ra aquecer um grama de água de 14,5 °C a 15,5 °C. Seu múltiplo é a quilocaloria, (kcal), sendo que:
Relação entre cal, joule:

O aparelho usado para medir a quantidade de calor envolvida nas transformações físicas ou químicas é o calorímetro.
Entalpia é o conteúdo de calor de um sistema, à pressão constante. Não é possível fazer a medida absoluta da entalpia de um sistema, mas podemos medir (com calorímetros), a variação de entalpia, DH, que ocorre numa reação. Esta variação é entendida como a diferença entre a entalpia final (dos produtos da reação) e a entalpia inicial (dos reagentes da reação).
![]()
DH = variação de entalpia
Hf = soma das entalpias dos produtos da reação
Hi = soma das entalpias dos reagentes da reação
2.1. Reações Exotérmicas
São aquelas que liberam calor para o meio ambiente.
Exemplos
Combustão da gasolina, queima da vela, etc.
Há uma diminuição do conteúdo calorífico do sistema. Se ocorre liberação de calor, podemos concluir que, no final, a quantidade de calor (Hf) contida no sistema é menor que no início (Hi) do processo.
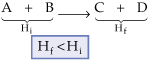
como DH= Hf – Hi, logo, DH < 0
![]()
Exemplos
Seja a combustão do acetileno:C2H2(g) + 5/2 O2(g) → 2 CO2(g) + H2O(g) ΔH = -310,6 kcal
De onde concluímos que durante esta reação, a 25 °C e 1 atm, são liberados 310,6 kcal para cada mol de acetileno queimado.
2.2. Reações Endotérmicas
São aquelas que absorvem calor do meio ambiente.
Exemplo
Decomposição da amônia, etc.
Numa reação endotérmica, há aumento do conteúdo calorífico do sistema. Se ocorre absorção de energia, podemos concluir que, no final, a quantidade de calor (Hf) contida no sistema é maior que no início do processo (Hi).
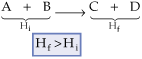
como DH = Hf – Hi, logo, DH > 0.
O DH das reações endotérmicas é positivo.
Exemplo
Seja a decomposição da água:
H2O(l)→ H2(g) + 1/2 O2(g) ΔH = + 68,4 kcal
de onde concluímos que durante essa reação, a 25 °C e 1 atm, são absorvidas 68,4 kcal para cada mol de água decomposta.
No diagrama de entalpia, relacionamos num eixo vertical os valores de Hi e Hf e podemos, portanto, calcular o valor de DH.
3.1. Diagrama de Reação Exotérmica
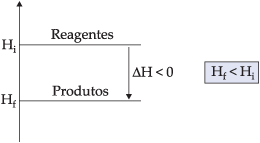
Os produtos possuem entalpia menor que os reagentes. Logo, houve perda de calor e o DH é negativo.
Exemplo
![]()
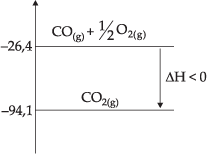
Hi = –26,4 kcal
Hf = –94,1 kcal
DH = Hf – Hi → DH = –94,1 – (–26,4)→ DH = – 67,7 kcal
Reação Exotérmica
DH negativo
3.2. Diagrama de Reação Endotérmica
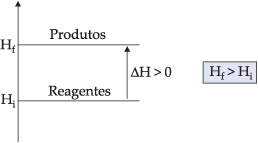
Os produtos possuem entalpia maior que os rea- gentes. Logo, houve ganho de calor e o DH é positivo.
Exemplos
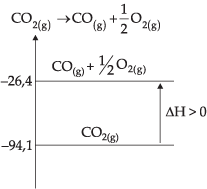
Hi = – 94,1 kcal
Hf = – 26,4 kcal
DH = Hf – H i → DH = – 26,4 – (–94,1)→ DH = +67,7 kcal
Reação Endotérmica
DH positivo

4.1. Estado Físico de Reagentes e Produtos
O estado físico de reagentes e produtos interfere no DH de uma reação. Se em um determinado processo ocorrido com os mesmos reagentes, no mesmo estado físico e mesmo produto, cujos estados físicos são diferentes, a energia liberada no estado sólido é maior que no estado líquido e esta é maior no estado gasoso. Isso acontece porque o vapor é um estado mais energético que o sólido.
Exemplificando
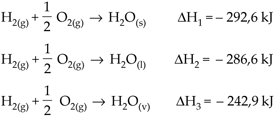
Observamos que os produtos diferem apenas no estado físico.
Graficamente, podemos representar:
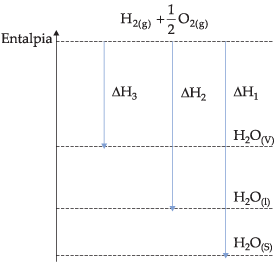
4.2. Estado Alotrópico de Reagentes e Produtos
Um mesmo elemento pode formar substâncias simples diferentes. A este fenômeno damos o nome de alotropia.
Na natureza encontramos muitas variedades alotrópicas, tais como:
– Carbono
![]()
– Enxofre
![]()
– Fósforo
![]()
– Oxigênio
![]()
Para uma reação envolvendo variedades alotrópicas de um mesmo elemento, vamos obter entalpias diferentes. Por exemplo:
C(grafite) + O2(g) → CO2(g) DH1 = – 392,9 kJ
C(diamante) + O2(g) → CO2(g) DH2 = – 395 kJ
Podemos dizer que o diamante apresenta, em sua estrutura cristalina, mais entalpia que o grafite. Portanto, o diamante é mais reativo (menos estável) que o grafite (mais estável).
Graficamente, encontramos:
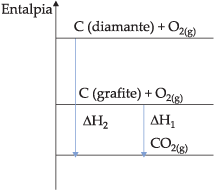
Para as demais formas alotrópicas citadas, podemos colocar:
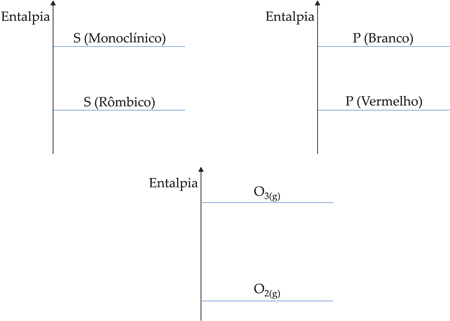
4.3. Temperatura
A determinação do ΔH deve ser feita a uma temperatura constante, pois se verifica, experimentalmente, que a variação de temperatura tem influência sobre o valor do ΔH. Normalmente, as determinações de DH são feitas em condições-padrão, ou seja, temperatura de 25 °C.
4.4. A Quantidade de Reagentes e Produtos
O DH de qualquer reação é determinado pela quantidade de reagentes envolvidos.
Exemplo
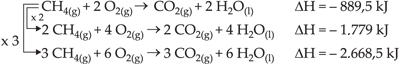
Como é impossível determinar o valor absoluto da entalpia de um sistema, adota-se um referencial ou padrão. Por convenção adotam-se as seguintes condições para ser um padrão:
• temperatura de 25 °C
• pressão de 1 atm
• estado físico mais comum a 25 °C e 1 atm
Exemplo
H2O(l), O2(g), Al(s), Hg(l), Cl2(g)
• estado alotrópico mais estável
Exemplo
C(gr), O2(g), S(R), P(V)
|
Observação Caso o padrão seja substância simples (elemento químico), a ela será atribuído arbitrariamente o valor zero de entalpia. |
Exemplos
H2O(l) ® é padrão, mas H ¹ 0 (não é substância simples)
H2(g) ® é padrão e substância simples, logo H = 0.
O2(l) ® é substância simples, mas não é padrão, logo H ¹ 0.
C(s,gr) ® é substância simples e está no estado alotrópico mais estável, logo H = 0.
Como determinar, então, uma entalpia relativa?
Veja a seguinte reação a 25 °C e 1 atm:
![]()
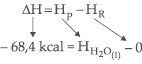
Assim, a entalpia água líquida (fórmula) é igual a – 68,4 kcal/mol.
A equação química é a representação da reação química. Equações que trazem, além dos reagentes e produtos, o estado físico (ou alotrópico) desses reagentes e produtos, a temperatura, a pressão do processo e a variação da entalpia envolvida na reação são chamadas equações termoquímicas.
S(rômico) + 1O2(g) ® 1SO2(g) DH = –70,92Kcal (a 25ºC e 1atm)
Significado: quando 1 mol de enxofre rômbico reage com 1 mol de oxigênio gasoso, liberam 70,92 kcal para formar 1 mol de dióxido de enxofre gasoso.
1C(gr) + 2S(R) ® 1CS2(l) DH = 18Kcal ( a 25ºC e 1atm)
Significado: quando 1 mol de carbono grafite reage com 2 mols de enxofre rômbico, ocorre absorção de 18 kcal para formar 1 mol de dissulfeto de carbono líquido.
|
Observação Quando na equação não aparecer indicação da temperatura e pressão, significa que o processo ocorreu a 25 °C e 1 atm (condições ambientes). |
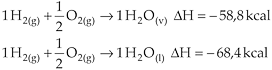
(a mudança do estado físico acarreta uma mudança no valor do DH).
C(gr) + O2(g) ® CO2(g) DH = – 94,1Kcal
C(d) + O2(g) ® CO2(g) DH = – 94,4Kcal
(a mudança do estado alotrópico acarreta uma mudança no valor do DH).
A variação de entalpia que ocorre numa reação é chamada de calor de reação ou entalpia de reação e é medida a 25 °C e 1 atm. Esse calor de reação recebe, conforme a reação, as seguintes denominações: calor de formação, calor de combustão, calor de neutralização etc.
7.1. Calor de Formação
É a quantidade de calor liberada ou absorvida durante a formação de 1 mol de um composto, a partir de substâncias simples, no estado padrão.
Por exemplo: a 25 °C e 1 atm, temos:
H2(g) +
![]() O2(g) ® 1H2O(l)
O2(g) ® 1H2O(l)
DH = –68,4 kcal / mol, o que significa que, para formar um mol de água líquida, a partir de substâncias simples, H2(g) e O2(g), no estado padrão (25 °C, e 1 atm, estado físico e alotrópico mais estável) há a liberação de 68,4 kcal.
Os valores das entalpias de formação são muito importantes, pois representam a própria entalpia de 1 mol da substância que está sendo formada, já que, nas reações de formação, Hi é sempre zero.
Exemplos
1)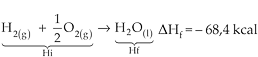
Como as entalpias do H2(g) e O2(g) são iguais a zero (estado padrão), a entalpia inicial, (Hi), também é zero, portanto:
DHf = Hf – Hi ® DHf = Hf – 0
DHf = Hf, logo DHf H2O(i) = – 68,4Kcal
DHf H2O(i), significa que 1 mol de água líquida possui a entalpia igual a – 68,4 kcal.
2)
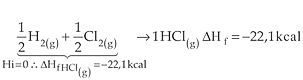
3)
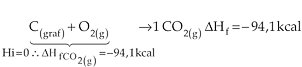
7.2. Calor de Combustão
É a variação de entalpia (DH) na combustão de 1 mol de uma substância a 25 °C e 1 atm.
Por exemplo
C6H12O6(s) + 6O2(g) ® 6CO2(g) + 6H2O(l) DHc = – 673 kcal/mol
logo a combustão de 1 mol de glicose libera 673 kcal.
O DH
nesse caso é sempre negativo, pois as combustões são sempre
exotérmicas.
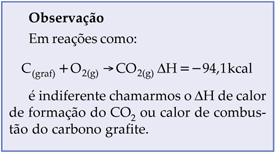
7.3. Energia de Ligação
Para rompermos uma ligação entre 2 átomos, devemos fornecer energia. Assim o processo é sempre endotérmico e o DH é sempre positivo. Quanto mais estável é a ligação, maior é a quantidade de energia absorvida para rompê-la.
Chamamos calor de ligação ou energia de ligação à quantidade de calor absorvida para rompermos um mol de ligações, considerando reagentes e produtos no estado gasoso, a 25 °C e 1 atm.

Com uma tabela de energia de ligação podemos calcular a energia total necessária para romper as ligações de 1 mol de moléculas, ou ainda, o que é mais importante, o DH das reações.
Exemplo
Conhecendo-se as seguintes energias de ligação;
C — H ... + 98,8 kcal/mol
C º C ... + 200,6 kcal/mol
podemos calcular a energia total necessária para "quebrar" as ligações de 1 mol de moléculas de acetileno (C2H2).
H — C º C — H(g) ® 2C(g) + 2H(g)
Quebramos
![]()
DH
= + 197,6 + 200,6 →
![]()
Porém, para calcularmos o ΔH de uma reação, usando valores de energia de ligação, devemos observar que se para romper ligações há absorção de de energia, para formar, há liberação de energia (processo exotérmico).
Cl2(g) → 2Cl(g) ΔH = +58 kcal
2Cl(g) → Cl2(g) ΔH = – 58 kcal
O ΔH será o saldo energético entre o calor absorvido no rompimento das ligações entre os átomos dos reagentes e o calor liberado na formação das ligações entre os átomos dos produtos.
Exemplo
Calcular o ΔH da reação:
C2H4(g) + H2(g) → C2H6(g)
conhecendo-se as seguintes energias de ligação, em kcal/mol:
C = C ... + 146,8
C — H ... + 98,8
C — C ... + 83,2
H — H ... + 104,2
Resolução
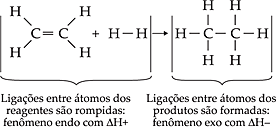
Total de ligações
quebradas:
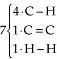
Total de ligações
formadas:
![]()
ΔH = 4 · 98,8 + 1 · 146,8 + 1 · 104,2 + 6 · (–98,8) + 1 · (– 83,2)
![]()
Porém, observando cuidadosamente a reação, podemos perceber que apenas houve o rompimento de uma ligação C = C (+ 146,8) e uma H – H (+ 104,2) enquanto formou-se uma ligação C – C (– 83,2) e duas C – H (2 · (– 98,8)):
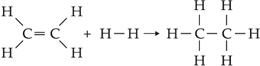
Somando-se os valores, obtemos o ΔH:
ΔH = + 146,8 + 104,2 – 83,2 – 197,6
|
DH = – 29,8 Kcal |
Por volta de 1840, Germain Herman Hess, trabalhando na determinação de certos calores de reação, cuja medida experimental era muito difícil, constatou que: "A variação de entalpia (ΔH) de uma reação química depende apenas dos estados final e inicial, não importando o caminho da reação". Esta importante lei experimental foi chamada de lei dos estados final ou inicial, lei de adição de calores ou, simplesmente, Lei de Hess.
Seja uma reação genérica A → B da qual se quer determinar o ΔH. Esta reação pode ser realizada por diversos caminhos, onde, para cada um deles, os estados inicial e final são os mesmos.
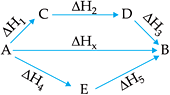
Para que A se transforme em B temos 3 caminhos:
A → B
A → C → D → B
A → E → B
sendo que:
ΔHx = ΔH1 + ΔH2 + ΔH3
ou
ΔHx = ΔH4 + ΔH5
Portanto, não importa o número de etapas que o processo apresenta, o ΔH da reação total será a soma dos ΔH das diversas etapas, e em conseqüência a equação termoquímica pode ser tratada como uma equação matemática. Logo, quando usamos a Lei de Hess no cálculo do DH de uma reação, devemos arrumar as equações fornecidas de modo que a soma delas seja a equação cujo ΔH estamos procurando. Para isso, usamos os seguintes procedimentos:
a) Somando várias equações, somamos também os respectivos ΔH;
b) Invertendo a equação, invertemos também o sinal do ΔH;
c) Multiplicando uma equação por um número qualquer (diferente de zero), multiplicamos também o ΔH, pelo mesmo número.
Este site foi atualizado em 04/03/19