 ADIÇÃO
E SUBSTITUIÇÃO EM CICLANOS
ADIÇÃO
E SUBSTITUIÇÃO EM CICLANOS
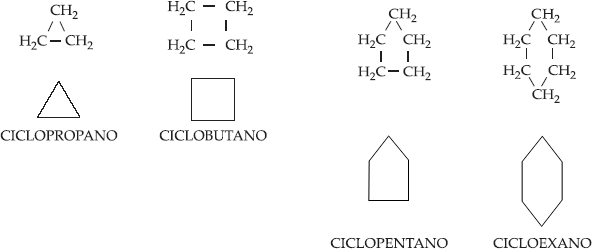
Ciclanos
ou cicloalcanos são hidrocarbonetos cíclicos
saturados, de fórmula geral CnH2n, também conhecidos
como cicloparafinas.
Os mais
importantes ciclanos são:
1.
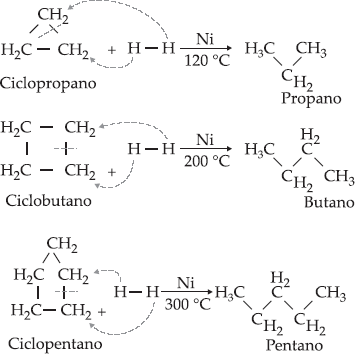
Propriedades Químicas dos Ciclanos
I.
Hidrogenação
Os
ciclanos com três átomos de carbono no ciclo adicionam hidrogênio, na
presença de níquel, à temperatura relativamente baixa (120 °C); os
ciclanos com quatro átomos de carbono no ciclo também adicionam
hidrogênio, na presença de níquel, à temperatura mais alta (200 °C); os
ciclanos com cinco átomos de carbono no ciclo adicionam hidrogênio, na
presença de níquel, à temperatura ainda mais alta (300 °C). Os ciclanos com
seis átomos de carbono no ciclo não adicionam hidrogênio. Em resumo os três
primeiros ciclanos (ciclopropano, ciclobutano e ciclopentano) dão reação
de adição e os demais ciclanos,
reação de substituição.
Por
exemplo:
II.
Halogenação
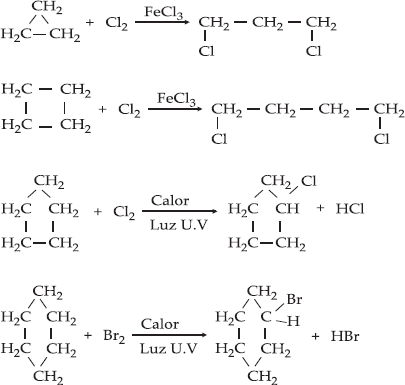
III. Reação com
Halogenidreto (HCl, HBr, HI)
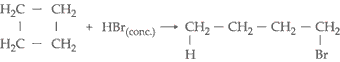
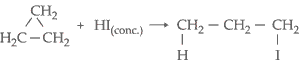

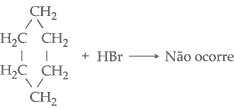
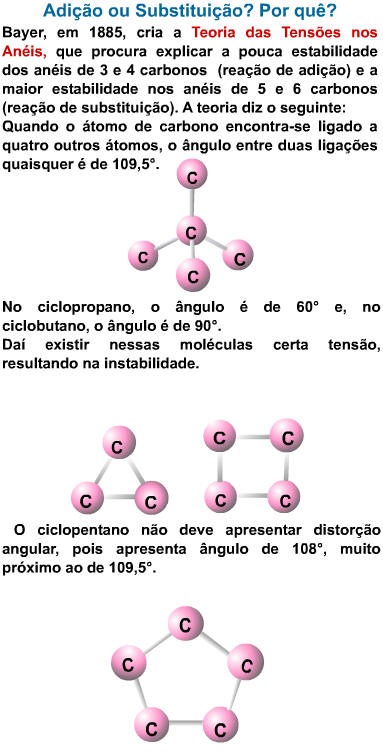
2. Teoria da Tensão dos Anéis de Bayer
Pelas reações anteriores,
conclui-se que a estabilidade dos ciclanos aumenta do ciclopropano
para o cicloexano.
Foi em 1885 que Adolf von
Bayer propôs uma teoria para explicar o comportamento diferente dos
ciclanos.
O ângulo formado por ligações
simples com duas unidades de covalência do carbono pode ser matematicamente
determinado e seu valor é de 109°28’.
Ângulo de Estabilidade Total
entre as Ligações.
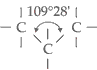
Num ciclo de 3 átomos de carbono,
o ângulo formado entre duas unidades de covalência é de 60°.
Existe, portanto, grande
tensão no ciclo e sua tendência é de abrir; daí a facilidade com que há
reação de adição com ruptura do ciclo.
Num ciclo com 4 átomos de
carbono, o ângulo formado entre duas unidades de covalência do carbono no
ciclo é de 90°:
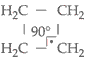
Neste caso, a tensão é menor e a
estabilidade do ciclo é maior que o ciclopropano. Mas a tensão no
ciclobutano continua, portanto, da reação de adição com ruptura do
ciclo.
Num ciclo com 5 átomos de
carbono, o ângulo formado entre duas unidades de covalência do carbono no
ciclo é de 108°:
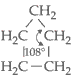
Praticamente não há tensão no ciclo, daí então sua grande estabilidade.
Porém, mesmo com esta tensão mínima, pode haver reação de adição com
ruptura do ciclo em condições enérgicas.
A
teoria de Bayer não não foi satisfatória para explicar a grande
estabilidade dos ciclos com seis ou mais átomos de carbono, porque admitia
que os seis ou mais átomos de carbono do ciclo estavam num mesmo plano, e,
sendo assim, haveria tensão no ciclo.
Assim,
no cicloexano, se os seis átomos de carbono estivessem num mesmo plano, o
ângulo formado entre duas unidades de covalência do carbono no ciclo seria
120º, e haveria tensão no ciclo, pois o ângulo normal é 109º 28’.
A
partir do ciclo de 6 átomos de carbono, à medida que aumentasse o número de
átomos de carbono no ciclo, deveria diminuir a sua estabilidade, pois
aumentaria a tensão, o que está em desacordo com a prática, pois estes
ciclos são muito estáveis.
Resumindo temos:
3. Teoria
de Sasche-Mohr
Em
1890, Sasche admitiu que nos hexaciclos, heptaciclos etc. os átomos de
carbono não estão num mesmo plano, e, sendo assim, o ciclo pode se
formar sem tensão. De fato, com o auxílio dos modelos de átomos de carbono,
podem-se construir os hexaciclos, heptaciclos etc., e verificar que os
átomos de carbono se distribuem em diversos planos e o ciclo não apresenta
tensão alguma. Sasche em sua teoria admitiu que, num hexaciclo, os seis
átomos de carbono podem se dispor espacialmente de duas maneiras diferentes.
Hexaciclo em forma de C (ou forma de barco) e hexaciclo em forma de Z (ou
forma de cadeira.
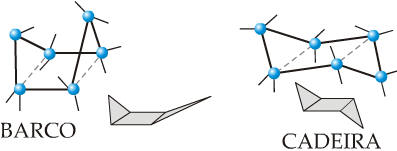
Em
ambas as formas não existe tensão no ciclo, pois o ângulo de ligação é
109°28’.
Com a
teoria, de Sasche surgiu o problema: deveriam existir dois isômeros do
cicloexano, correspondentes às formas C e Z. Na prática, porém, não se
verifica este tipo de isomeria.
Mohr,
com auxílio dos modelos de átomos de carbono, demonstrou que, facilmente, a
forma C passa para a forma Z e vice-versa com uma ligeira torção no ciclo.
Mohr admitiu então que no cicloexano as moléculas com ciclo na forma C estão
continuamente se convertendo em moléculas com ciclo na forma Z e vice-versa,
não se podendo isolar uma das formas, que seria um dos isômeros.]
Portanto, os ciclanos com 6 ou mais de 6 carbonos são estáveis e por isso
não existe ruptura na ligação do seu ciclo, portanto, só apresentam
reação de substituição.
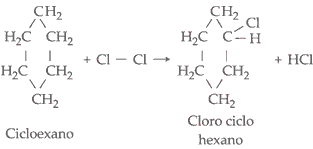
Home | Substituição Alcanos | Substituição Aromáticos | Adição Alcenos | Adição Alcinos | Adição Alcadienos | Adição Substituição Ciclanos | Eliminação | Oxidação | Esterificação | Saponificação
Este site foi atualizado em
04/03/19