PROFESSSOR
PAULO CESAR
|
PROFESSSOR PAULO CESAR |
|
|
|
|
|
|
|||||||
|
|||||
Quando a luz atravessa a solução sem sofrer desvio, a substância é opticamente inativa. Quando a luz atravessa a solução e sofre desvio, a substância é opticamente ativa e apresenta isometria óptica. Se o desvio foi à direita, o isômero é chamado de dextrogiro; se o desvio foi à esquerda, o isômero é chamado de levogiro.
A
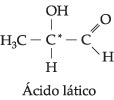
assimetria molecular é encontrada em moléculas que apresentam carbono quiral.
![]()
Carbono quiral (C *) é aquele que se liga a quatro
átomos ou radicais diferentes entre si.

Isomeria Óptica com 1 Carbono Quiral
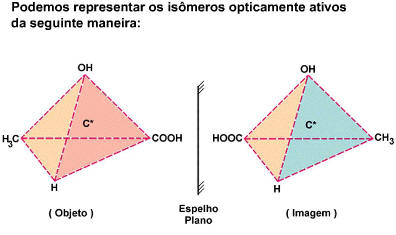
Todo composto que apresenta um carbono quiral na molécula será representado sempre por dois isômeros opticamente ativos: um dextrogiro e outro levogiro, cujas moléculas funcionam como objeto e imagem em relação a um espelho plano.
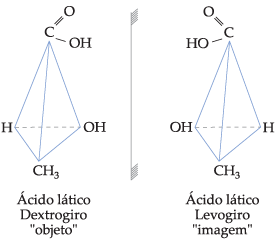
A todo isômero dextrogiro
corresponde um levogiro, os dois desviam o plano de vibração da luz
polarizada do mesmo ângulo para lados opostos. Assim, o primeiro desviará de
+![]() e, o segundo, de –
e, o segundo, de –![]() .
Os isômeros que são imagem um do outro num espelho plano denominam-se
enantiômeros.
.
Os isômeros que são imagem um do outro num espelho plano denominam-se
enantiômeros.
![]()
As moléculas que não se podem sobrepor às
respectivas imagens num espelho plano são denominadas de quirais
(antigamente denominadas de assimétricas). Portanto, num composto cujas
moléculas são quirais, encontramos moléculas dextrogiras e levogiras (enantiômeros).
![]()
Se misturarmos quantidades iguais de enantiômeros,
obteremos o racêmico, que é opticamente inativo (inativo por compensação
externa).

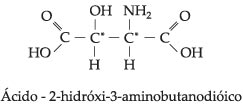
Outros exemplos de compostos que apresentam um carbono quiral na molécula e que, por isso, são representados por enantiômeros e por racêmico.
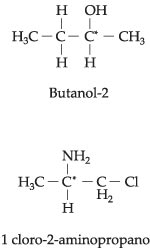
Isomeria Óptica Com 2 Carbonos Quirais Diferentes
Exemplo
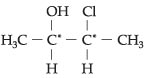
Os carbonos de números 2 e 3 são
quirais e diferentes, pois um está ligado a – OH e, outro, ao – Cl.
![]()
Os ângulos de desvio produzidos por eles serão,
portanto, diferentes.
![]()
Suponhamos que um seja responsável por um desvio
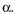 e, outro,
por
e, outro,
por 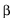 e
convencionemos, por exemplo:
e
convencionemos, por exemplo:
Se representarmos por sinas + e – os desvios para a direita e para a esquerda, respectivamente, teremos os seguintes isômeros possíveis:
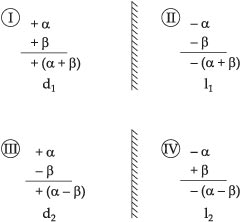
Se misturarmos quantidades iguais
dos enantiômeros d1 e l1, teremos o racêmico r1.
![]()
Se fizermos o mesmo para os isômeros d2 e
l2, teremos o racêmico r2.
![]()
Outros exemplos de compostos com dois carbonos
quirais diferentes:
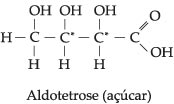
Isometria Óptica Com n Carbonos Quirais Diferentes

Fórmulas de Van’t Hoff

Isometria Óptica, com dois Carbonos Quirais Iguais
Seja, por exemplo, o composto:
Os carbonos de números 2 e 3 são quirais, porém
iguais. Se considerarmos, portanto, que um deles é responsável por um desvio
a do plano de vibração da luz polarizada, o outro também o será.
![]()
O número de isômeros possíveis será o seguinte:
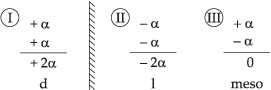
r = d + l (em quantidades iguais)
Conclusão
![]()
Toda fórmula que apresente dois carbonos quirais
iguais será responsável por quatro possibilidades, sendo duas substâncias
opticamente ativas, uma substância opticamente inativa e uma
mistura racêmica.
![]()
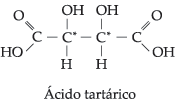
Assim, para o ácido tartárico, as quatro
possibilidades são as seguintes:
![]()
I) ácido tartárico dextrogiro.
![]()
II) ácido tartárico levogiro.
![]()
III) ácido mesotartárico ou ácido tartárico inativo
por compensação interna.
IV) ácido tartárico racêmico ou ácido tartárico
inativo por compensação externa.
![]()
Outros exemplos de compostos com dois carbonos
quirais iguais:
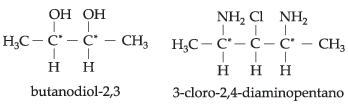
Isometria Óptica em dois compostos Cíclicos
isomeria óptica também é observada em compostos
cíclicos, embora estes não apresentem carbono quiral. Para que a quantidade
de isômeros possa ser determinada, devemos considerar a existência do
carbono quiral.
![]()
O composto cíclico que apresenta assimetria
molecular deve possuir carbono com ligantes diferentes. Consideremos o
composto 2-metil-1-cloro-ciclopropano.
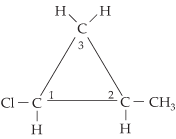
Observamos que existem dois carbonos no anel (1 e 2) que podem ser considerados como quirais. A quantidade de isômeros é calculada da seguinte maneira:
Isômeros opticamente ativos: 2n = 22 = 4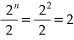
![]()
As fórmulas estruturais dos isômeros ficam:
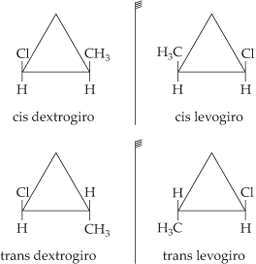
Quando dois carbonos do anel possuem os ligantes iguais entre si, possui assimetria molecular somente a forma trans. Consideremos a substância 1,2 dibromo-ciclopropano:
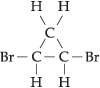
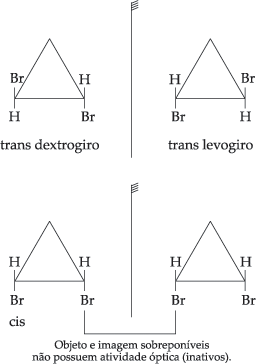
Resumindo temos.....
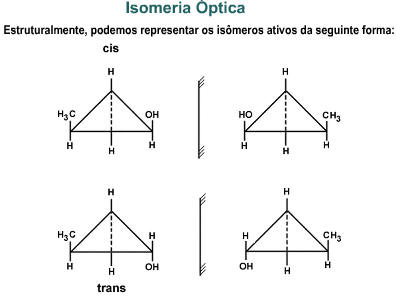
Compostos com duas duplas ligações
A isomeria ótica é observada nos compostos com duas duplas acumuladas, ou seja, no mesmo átomo de carbono. Tais compostos são denominados de alênicos.
![]()
Exemplo
Este site foi atualizado em 04/03/19