 REAÇÕES
DE OXIDAÇÃO
REAÇÕES
DE OXIDAÇÃO
As
reações de oxirredução são as que ocorrem com mudança do número de oxidação.
Na
oxidação verifica-se a perda de elétrons e conseqüentemente o aumento do
número de oxidação. Para os compostos orgânicos, verifica-se reação com o
oxigênio e o aumento do número de oxidação do carbono envolvido.
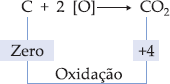
1. Ozonólise de Alcenos
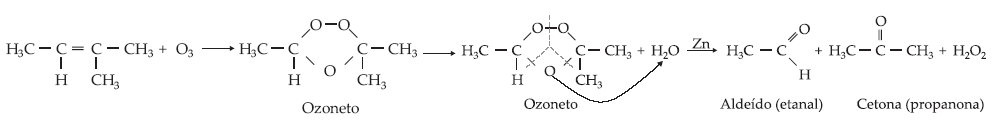
É a
reação com ozônio (O3), formando ozonetos ou ozonídeos, seguida
por hidrólise (quebra pela água) do ozoneto formado, o que permite a
obtenção de aldeído e/ou cetona com formação de peróxido de
hidrogênio.
O
produto obtido depende do tipo de cada carbono que faz a ligação dupla:
A – Se
ambos os carbonos que fazem a ligação dupla forem primários ou secundários,
obteremos apenas aldeído.
B – Se
ambos os carbonos que fazem a ligação dupla forem terciários, obteremos
apenas cetonas.
C – Se
um dos carbonos que fazem a ligação dupla for primário ou secundário e o
outro terciário, obteremos uma mistura de aldeído e cetona.
Exemplos
–
Ozonólise do 2-metil-2-buteno
–
Ozonólise do 2-buteno
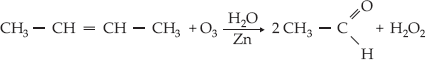
–
Ozonólise do 2,3-dimetil-2-buteno
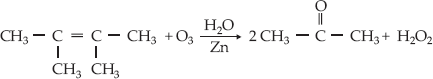
Observação
Para
evitar a oxidação do aldeído pela água oxigenada, deve-se utilizar zinco na
reação.
A
ozonólise caracteriza-se pela sua seletividade de não produzir ácidos
carboxílicos.
Aplicação da Ozonólise
1)
Método de obtenção de aldeídos e cetonas
2)
Determinação da posição da dupla ligação na molécula. Para isso proceder da
seguinte maneira: eliminar os átomos de oxigênio das duas moléculas
resultantes e unir por dupla ligação os carbonos do radical funcional.
Exemplo
Um
alceno forneceu por ozonólise aldeído acético e propanona. Qual é o alceno?
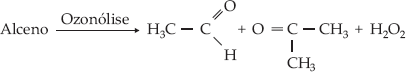
O
alceno é, portanto:
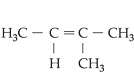 2-metil-2-buteno
2-metil-2-buteno
2.
Oxidação Branda de Alcenos
Os
alcenos são oxidados pelo KMnO4 (permanganato de potássio) em
meio básico (NaHCO3 ou Na2CO3) ou meio
neutro, formando diálcoois vicinais denominados glicóis. O oxidante brando
mais usado é o KMnO4/NaHCO3, conhecido como reativo de
Bayer.
Em meio
alcalino o KMnO4 é um oxidante brando, dando-se a seguinte
reação:
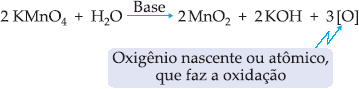
Exemplo
de oxidação branda de alcenos:
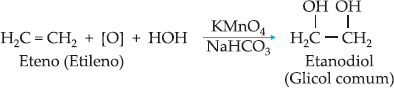
Importante!!
Em
função da cor violeta da solução de KMnO4, a reação de Bayer pode
ser aplicada para se distinguir um alceno do ciclano isômero; com KMnO4
em meio alcalino o ciclano não reage.

3.
Oxidação Enérgica de Alcenos
São
exemplos de oxidantes enérgicos: mistura sulfopermangânica (KMnO4/
H2SO4) e mistura sulfocrômica (K2Cr2O7/
H2SO4).
O KMnO4
, em meio ácido, é um oxidante enérgico, dando-se a reação:
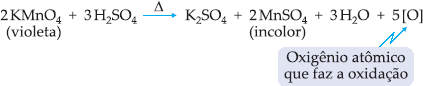
Um
alceno, quando submetido a um oxidante enérgico, sofre oxidação com ruptura
da dupla ligação, podendo haver formação de ácidos carboxílicos, cetonas ou
gás carbônico.
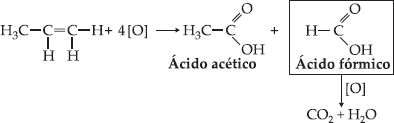
*
Haverá formação de gás carbônico em vez de ácido metanóico se a dupla
ligação estiver localizada na extremidade da cadeia; isso acontece porque o
ácido metanóico possui a propriedade de ser atacado pelo oxigênio, pois o
ácido fórmico apresenta caráter redutor.
Exemplos
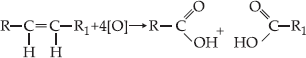
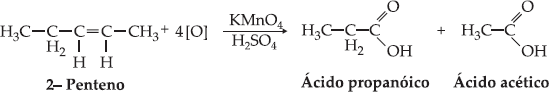
Quando
o alceno apresentar ramificações nos carbonos da dupla ligação, obteremos
cetona ao invés de ácido carboxílico.
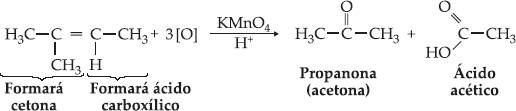
Aplicação da Oxidação Enérgica
A reação com KMnO4/H2SO4
pode ser empregada na localização da dupla ligação de um alceno
desconhecido, além de se constituir num método para obtenção de cetonas e/ou
ácidos carboxílicos.
Exemplo
Um alceno produz com
KMnO4/ H2SO4 , ácido propanóico e butanona:
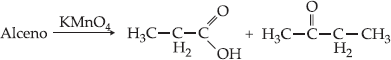
O alceno é:
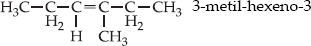
Observação
A
reação de um composto orgânico com oxigênio atômico ou molecular é uma
reação de oxidação do composto orgânico, pois o número de oxidação ou Nox do
carbono aumenta. O permanganato de potássio é chamado de agente oxidante.
Outro agente oxidante muito empregado em Química Orgânica é o dicromato de
potássio (K2Cr2O7).
4.
Oxidação Enérgica dos Álcoois
I. Álcool Primário
Os
álcoois primários podem oxidar-se parcial ou totalmente.
A
oxidação parcial de um álcool primário produz aldeído, que é novamente
oxidado e produz ácido carboxílico, o que nos leva a concluir que a oxidação
total de um álcool primário terá como produto final um ácido carboxílico.
A
oxidação de um álcool primário a ácido carboxílico é possível porque o
carbono do grupo – OH de um álcool primário possui, no mínimo, 2 ligações
com hidrogênio.
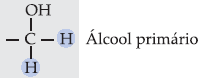
Um dos
métodos para oxidar álcool primário a aldeído e depois a ácido carboxílico
consiste em usar solução de dicromato de potássio, K2Cr2O7
, como agente oxidante.
Essa
solução que possui o íon dicromato
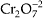 tem
coloração vermelho-alaranjada. Quando esse íon oxida o álcool, o cromo sofre
redução, passando a Cr2O3 de coloração verde (esta
reação é a que acontece nos bafômetros).
tem
coloração vermelho-alaranjada. Quando esse íon oxida o álcool, o cromo sofre
redução, passando a Cr2O3 de coloração verde (esta
reação é a que acontece nos bafômetros).
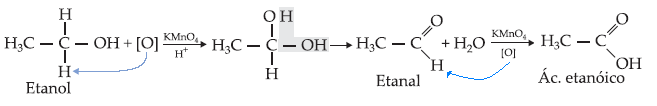
Caso Especial
Oxidação do metanol
(Possui
3 ligações com hidrogênio e, portanto, 3 pontos a serem oxidados na
molécula.)
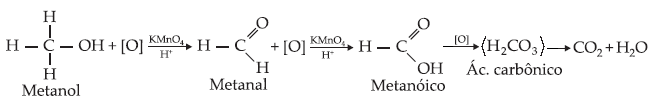
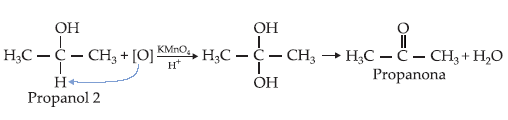
II. Álcool Secundário
Os álcoois secundários
são oxidados a cetonas, pois o carbono do grupo – OH, neste caso, possui
apenas 1 ligação com hidrogênio.
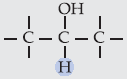
Exemplo
III. Álcool
Terciário
Como neste caso o
carbono do grupo – OH não possui ligações com hidrogênio, os álcoois
terciários não sofrem reação de oxidação.
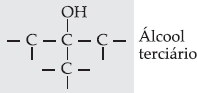
5. Diferenciação
Prática de Aldeídos e Cetonas
Em laboratórios, faz-se
a diferenciação entre aldeído e cetona com base no fato de que os aldeídos
são facilmente oxidados e as cetonas não o são.
Para isso, usam-se
reativos especiais que, ao provocarem a oxidação do aldeído e,
conseqüentemente, ao sofrerem redução, produzem um sinal físico facilmente
identificável como, por exemplo, uma mudança de cor.
Uma vez que a cetona
não sofre oxidação, seu contato com esses reativos não produz sinal algum e
assim verifica-se, experimentalmente, se determinado composto é um aldeído
ou uma cetona.
I. Reativo de Tollens
Solução Amoniacal de Nitrato de Prata
Os aldeídos produzem um
precipitado de prata metálica nas paredes do frasco, formando um espelho de
prata.
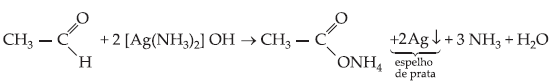
As cetonas não reagem
com reativo de Tollens.
II. Reativo
de Fehling
Mistura de solução
alcalina de tartarato duplo de sódio e potássio (sal de seignette) e solução
de CuSO4.
A mistura é um líquido
de cor azul escuro que contém o íon cobre II.
Os aldeídos, quando
tratados pelo licor de Fehling, dão um precipitado vermelho-marrom de óxido
cuproso.
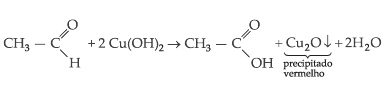
As cetonas não reagem
com o licor de Fehling.
6. Combustão
É uma reação que
corresponde à queima de um composto que é alimentada pelo gás oxigênio, que
recebe o nome de comburente. A combustão completa de compostos orgânicos,
geralmente hidrocarbonetos e álcoois, produz dióxido de carbono (CO2)
e água na forma de vapor.
Se a combustão for
incompleta, além de água pode haver a formação de carbono ou monóxido de
carbono.
Exemplo
Combustão Completa
a) CH4 + 2O2
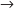 CO2
+ 2H2O
CO2
+ 2H2O
b) C2H2
+ 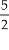 O2
O2
 2CO2
+ H2O
2CO2
+ H2O
c) C2H5OH
+ 3O2
 2CO2
+ 3H2O
2CO2
+ 3H2O
Observe que o
balanceamento da equação deve ser feito considerando-se a combustão (queima)
de um mol do composto orgânico, iniciando-se pelo carbono, em seguida
hidrogênio e finalmente oxigênio, se for o caso.
Combustão Incompleta
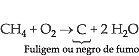

Na combustão incompleta
nota-se a presença de fuligem (carbono) e monóxido de carbono; isto se deve
à quantidade insuficiente de oxigênio molecular (O2) para
realizar a combustão total.
Home | Substituição Alcanos | Substituição Aromáticos | Adição Alcenos | Adição Alcinos | Adição Alcadienos | Adição Substituição Ciclanos | Eliminação | Oxidação | Esterificação | Saponificação
Este site foi atualizado em
04/03/19