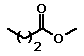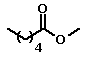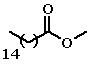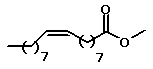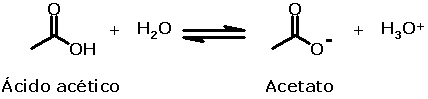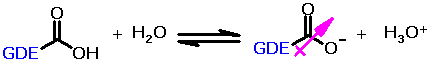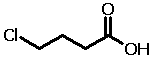









|
|
A Química DOS SENTIDOS:
PALADAR E OLFATO
Neuroquímica dos sentidos


Você, todo dia, entra em contato com o mundo externo,
ou seja, tudo aquilo que está além dos limites do seu eu. Esse
contato é feito através dos sentidos, que nos seres humanos são
definidos classicamente, desde Aristóteles, como cinco: olfato, paladar,
visão, tato e audição. É através das sensações captadas por eles que nos
relacionamos com o ambiente ao nosso redor, permitindo que nos adaptemos
e sobrevivamos.
No Museu da Idade Média, também conhecido como Museu
de Cluny, em Paris (França), há uma série de seis tapeçarias, datadas do
século XV, denominadas A Dama e o Unicórnio. Cinco delas são
dedicadas aos cinco sentidos, uma para cada um.
Observe cada uma delas:
 O
olfato é o mais primitivo dos cinco sentidos, uma vez que o
rinencéfalo (rhino, nariz, en, dentro, cephalos,
cabeça), que contém as estruturas responsáveis pelas sensações do olfato
e do paladar e pelo controle de funções vegetativas, faz parte do
paleocéfalo. Diretamente associados ao sistema límbico, que controla as
respostas emocionais do indivíduo, os odores promovem reações
instintivas muito fortes – normalmente respostas binárias, como sim ou
não (atração ou repulsão). O olfato é menos desenvolvido nos humanos do
que em outros animais, como os cães, que por isso são empregados na
detecção de substâncias químicas proibidas em locais públicos e em meios
de transporte. O
olfato é o mais primitivo dos cinco sentidos, uma vez que o
rinencéfalo (rhino, nariz, en, dentro, cephalos,
cabeça), que contém as estruturas responsáveis pelas sensações do olfato
e do paladar e pelo controle de funções vegetativas, faz parte do
paleocéfalo. Diretamente associados ao sistema límbico, que controla as
respostas emocionais do indivíduo, os odores promovem reações
instintivas muito fortes – normalmente respostas binárias, como sim ou
não (atração ou repulsão). O olfato é menos desenvolvido nos humanos do
que em outros animais, como os cães, que por isso são empregados na
detecção de substâncias químicas proibidas em locais públicos e em meios
de transporte.
 O
paladar é o sentido do sabor dos materiais que entram em contato
com as papilas gustativas localizadas na língua. É um sentido
extremamente associado ao olfato; muitas vezes, quando estamos com esse
sentido comprometido (por exemplo, durante uma gripe), fica alterada a
sensação do sabor dos alimentos. Tanto o olfato quanto o paladar podem
ser classificados como sentidos químicos, porque ocorre uma interação
direta entre as substâncias químicas e os receptores presentes no nariz
e na língua. O
paladar é o sentido do sabor dos materiais que entram em contato
com as papilas gustativas localizadas na língua. É um sentido
extremamente associado ao olfato; muitas vezes, quando estamos com esse
sentido comprometido (por exemplo, durante uma gripe), fica alterada a
sensação do sabor dos alimentos. Tanto o olfato quanto o paladar podem
ser classificados como sentidos químicos, porque ocorre uma interação
direta entre as substâncias químicas e os receptores presentes no nariz
e na língua.
 A
visão é, na verdade, um conjunto de dois sentidos: o sentido de
percepção da cor e o sentido da percepção da luminosidade. Ainda que não
seja um sentido químico, por não haver interação entre substâncias
químicas e receptores protéicos específicos, este sentido depende das
propriedades eletrônicas dos compostos presentes naquilo que é visto,
pois estas irão determinar as propriedades de absorção de radiação
luminosa desses objetos e, conseqüentemente, irão determinar as
propriedades da radiação que emitem ou refletem – que é o que os olhos
detectam. A
visão é, na verdade, um conjunto de dois sentidos: o sentido de
percepção da cor e o sentido da percepção da luminosidade. Ainda que não
seja um sentido químico, por não haver interação entre substâncias
químicas e receptores protéicos específicos, este sentido depende das
propriedades eletrônicas dos compostos presentes naquilo que é visto,
pois estas irão determinar as propriedades de absorção de radiação
luminosa desses objetos e, conseqüentemente, irão determinar as
propriedades da radiação que emitem ou refletem – que é o que os olhos
detectam.
 O
tato é um sentido de mecanocepção, ou seja, de percepção de
estímulos mecânicos, especialmente de pressão, sobre o maior órgão do
corpo humano: a pele. Existem diversos tipos de receptores do tato, cada
qual capaz de diferenciar sensações específicas, como toques leves e
toques fortes, entre outros. Há ainda a percepção de temperatura, com
receptores específicos para as sensações de calor e frio. Embora
classicamente incluída no sentido do tato, esta percepção de temperatura
é hoje considerada um sentido diferente, a termocepção. O
tato é um sentido de mecanocepção, ou seja, de percepção de
estímulos mecânicos, especialmente de pressão, sobre o maior órgão do
corpo humano: a pele. Existem diversos tipos de receptores do tato, cada
qual capaz de diferenciar sensações específicas, como toques leves e
toques fortes, entre outros. Há ainda a percepção de temperatura, com
receptores específicos para as sensações de calor e frio. Embora
classicamente incluída no sentido do tato, esta percepção de temperatura
é hoje considerada um sentido diferente, a termocepção.
 Assim
como a visão e o tato, a audição é um sentido físico, ou seja,
independe da interação entre moléculas e receptores no organismo. Ela
consiste na percepção da alteração da pressão que as ondas mecânicas do
som fazem sobre membranas presentes nas estruturas dos ouvidos. O som
também é percebido pelo sentido do tato; sons que não estimulam a
audição humana (fora da faixa entre 9 a 22.000 Hz) podem ser percebidos
pelo sentido da mecanocepção. Assim
como a visão e o tato, a audição é um sentido físico, ou seja,
independe da interação entre moléculas e receptores no organismo. Ela
consiste na percepção da alteração da pressão que as ondas mecânicas do
som fazem sobre membranas presentes nas estruturas dos ouvidos. O som
também é percebido pelo sentido do tato; sons que não estimulam a
audição humana (fora da faixa entre 9 a 22.000 Hz) podem ser percebidos
pelo sentido da mecanocepção.
Atualmente, essa definição
clássica de cinco sentidos é contestada. Nos humanos, por exemplo,
existem outros sentidos, como a nocicepção (percepção da dor) e a
propiocepção, que é a percepção de seu próprio corpo e da localização
espaço-temporal de cada uma de suas partes. Outros animais possuem
sentidos inexistentes em humanos, como a magnetocepção (percepção do
campo magnético terrestre), de aves e insetos, e a eletrodetecção
(percepção de campos elétricos), encontrada em peixes e em mamíferos da
ordem Monotrêmata, como o ornitorrinco.

Você já viu que existem seis tapeçarias da série “A
Dama e o Unicórnio”. Enquanto cinco delas tratam dos cinco sentidos
clássicos, a sexta tapeçaria foge a essa proposta. Ela é denominada
Meu único desejo, é a frase que está escrita na tapeçaria. Seu
significado tem despertado inúmeros debates, e uma das propostas para
explicar seu significado é de que ela trata da capacidade humana de ir
além dos sentidos, ou seja, da capacidade de integrar essas sensações
primárias e criar aquilo que denominamos conhecimento. Assim,
conhecer é apreender a realidade externa a nós e criar modelos do
mundo real em nossas mentes.

http://www.musee-moyenage.fr/homes/home_id20393_u1l2.htm
Esta integração das sensações é realizada no
encéfalo, que é parte do sistema nervoso central. Clique na figura a
seguir para aprender mais sobre a estrutura do sistema nervoso dos
mamíferos.
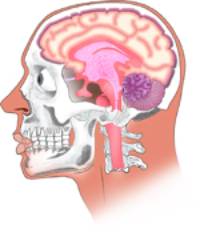
CLIQUE PARA VER A ANIMAÇÃO
O tipo de célula presente em todo o sistema nervoso é
o neurônio. Conheça mais sobre a estrutura desta célula clicando na
figura a seguir:
CLIQUE PARA VER A ANIMAÇÃO
Como você pode observar, o neurônio transmite a
informação através de uma corrente elétrica que se propaga ao longo de
sua membrana plasmática. Relembrar a estrutura da membrana plasmática:
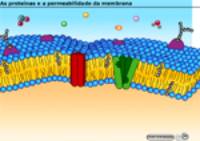
CLIQUE PARA VER A ANIMAÇÃO
Em células eletricamente excitáveis, como os
neurônios, a membrana plasmática é capaz de conduzir um impulso elétrico
pela geração de uma diferença de potencial entre o meio interno e o meio
externo (intra e extracelular). Essa diferença de potencial é gerada
pela acumulação de íons de cargas opostas em cada uma das faces da
membrana, o que é possível devido à permeabilidade seletiva da membrana
para os diferentes íons.

CLIQUE PARA VER A ANIMAÇÃO

Como você já viu, a transmissão do impulso
nervoso ao longo da membrana plasmática depende de etapas
subseqüentes de despolarização e repolarização. Observe esse
processo com mais detalhes:
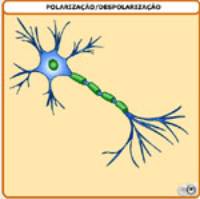
CLIQUE PARA VER A ANIMAÇÃO
Esse processo se propaga ao longo da membrana
plasmática até chegar à sinapse. Veja como é a sua estrutura:
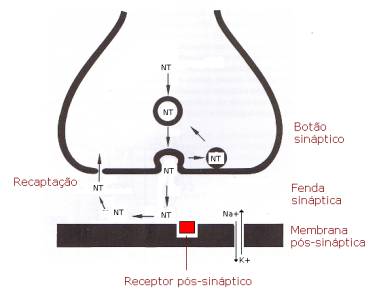
Nesse ponto, não há contato físico direto entre o
neurônio pré-sináptico e a célula pós-sináptica (outro neurônio ou
uma célula efetora). Como essas duas células irão se comunicar?
Nos organismos vivos, a conversação entre
duas células é de natureza química, e o vocabulário empregado
são os mediadores químicos. Observe os tipos de diálogos que
as células podem ter:
CLIQUE PARA VER A ANIMAÇÃO
Repare que o diálogo entre o neurônio
pré-sináptico e a célula pós-sináptica é feita pela liberação de um
neurotransmissor, que se difunde na fenda sináptica até se ligar ao
seu receptor pós-sináptico, que é uma proteína capaz de reconhecer
seletivamente a estrutura desse neurotransmissor. De que forma a
mensagem carreada por este neurotransmissor atinge o interior da
célula pós-sináptica, se essa ligação com o receptor se dá na face
externa da sua membrana celular?
Essa mensagem pode ser passada para o interior da
célula através de dois processos diferentes. O primeiro deles
envolve a formação de segundos mensageiros intracelulares, promovida
pela ligação do neurotransmissor ao seu receptor. Veja como isso
ocorre:
CLIQUE PARA VER A ANIMAÇÃO
O segundo tipo de processo que pode ocorrer para
levar a informação do neurônio pré-sináptico para a célula
pós-sináptica é através da mudança da concentração de certos íons
nesta última. Isso é mediado pela abertura ou fechamento de canais
iônicos acoplados aos receptores:
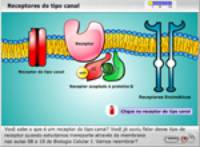
CLIQUE PARA VER A ANIMAÇÃO
É dessa forma que as sensações percebidas nos
órgãos dos sentidos são conduzidas até o nosso cérebro: elas geram
um impulso nervoso, que será conduzido por neurônios até o SNC, onde
a informação será processada e, caso necessário, uma resposta será
enviada aos diversos órgãos do organismo, agora seguindo o caminho
inverso: um impulso será disparado do SNC e será conduzido por
neurônios até as células efetoras. Por exemplo, quando sentimos o
odor e o sabor dos alimentos, esta informação, depois de processada
pelo cérebro, disparará a secreção salivar e a secreção de suco
gástrico, entre outros efeitos.
Os neurotransmissores podem ser excitatórios, ou
seja, podem excitar a célula pós-sináptica, ou podem ser
inibitórios. É o balanço entre esses neurotransmissores que regula o
funcionamento normal do organismo; o desequilíbrio na produção de
algum deles pode gerar doenças muito severas, como o
Mal de Parkinson.
Um grande número de neurotransmissores
localizados no SNC pertence à classe das aminas biogênicas, como a
norepinefrina (noradrenalina), a dopamina, a histamina e a
serotonina. A biossíntese desses compostos se dá principalmente pela
descarboxilação de aminoácidos, podendo ocorrer também oxidação
de anéis aromáticos, com conseqüente introdução de hidroxilas
fenólicas. Todos os receptores de aminas biogênicas são acoplados a
proteínas G.
A serotonina, também conhecida como 5-hidroxitriptamina
(5-HT), é biossintetizada a partir do aminoácido L-triptofano. Até o
momento, foram identificadas sete subfamílias de receptores
serotoninérgicos; essas subfamílias podem ser divididas em
diferentes populações de receptores. Por exemplo, a subfamília 5HT1
é constituída por 10 subtipos de receptores. Os receptores 5HT1A
estão localizados em alta densidade no hipocampo, amígdala, septo e
sistema límbico. Esses receptores estão envolvidos no controle da
ansiedade, depressão, agressividade, impulsividade e alcoolismo.
Outros receptores serotoninérgicos parecem estar envolvidos com o
controle da depressão e de quadros de psicose, como os subtipos 2A,
3, 5, 6 e 7, enquanto o subtipo 4 parece estar envolvido com os
processos de aprendizagem e memória e presente em baixo número em
pacientes portadores do
Mal de
Alzheimer.
Desde o final da década de 1920 havia indícios de
que a adenosina e seus nucleotídeos (AMP, ADP e ATP) atuavam como
neurotransmissores no SNC e em órgãos periféricos, modulando ações
como o controle da pressão arterial e contração intestinal. Somente
na década de 1970 foram identificados dois tipos de receptores
purinérgicos, os receptores P1 (maior afinidade para adenosina) e P2
(maior afinidade para ATP). Atualmente são conhecidos quatro
receptores de adenosina (A1, A2A, A2B e A3),
acoplados a proteínas G, sete receptores para nucleotídeos (AMP, ADP,
ATP e UTP) do tipo P2X (P2X1 a P2X7),
acoplados a canais iônicos, e pelo menos sete receptores do tipo
P2Y, acoplados a proteínas G. Os receptores purinérgicos têm
demonstrado um papel fundamental no controle de diversas funções do
SNC, atuando nos processos epilépticos e neurodegenerativos, na
indução do sono, na doença de Parkinson e nos quadros de psicose;
nestes dois últimos, seus efeitos demonstram ser indiretos, através
da modulação de receptores dopaminérgicos.
A acetilcolina (Ach) é um neurotransmissor
envolvido nos processos cognitivos e de manutenção da atenção no SNC.
Seus efeitos são mediados por dois tipos de receptores: um acoplado
à proteína G, de alta afinidade pela muscarina (receptor muscarínico),
e outro ionotrópico e de alta afinidade pela nicotina (receptor
nicotínico).
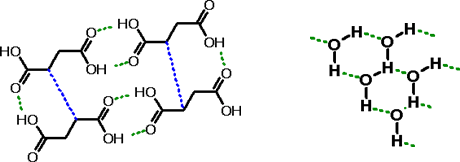
Átomos e ligações que se correspondem em cada
estrutura encontram-se marcados com cores específicas: em azul,
átomo de nitrogênio quaternário; em vermelho, sítio doador de
elétrons para ligação hidrogênio; em verde, cadeia espaçadora entre
eles.
Três aminoácidos desempenham um papel fundamental
nos processos de transmissão sináptica rápida: o glutamato (excitatório),
o ácido gama-aminobutírico (ou GABA) e a glicina
(inibitória).
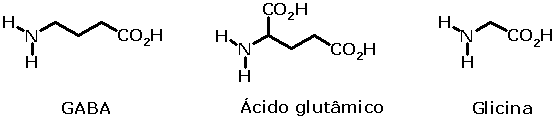
O ácido glutâmico (glutamato) é um
neurotransmissor excitatório amplamente distribuído, presente em
mais de 50% do tecido nervoso. Possui papel fundamental no
desenvolvimento do tecido nervoso e é responsável por sua
plasticidade no sistema nervoso amadurecido. Está diretamente
relacionado aos processos de aprendizado e memória, bem como no
desenvolvimento de diversas patologias neurodegenerativas. Já o GABA
e a glicina são neurtotransmissores inibitórios, e estão envolvidos
com a ansiedade e a epilepsia.
Um grande número de neuropeptídeos também atua
como neurotransmissores no SNC, como os opiáceos endógenos, os
hormônios hipotalâmicos, as taquicininas e as melanocortinas. Vários
destes neuropeptídeos demonstram estar associados a certas
patologias do SNC e ligantes específicos de seus receptores vêm
sendo desenvolvidos como candidatos a novos fármacos. Por exemplo,
antagonistas do receptor NK1 da substância P apresentam atividade
antidepressiva e ansiolítica. Receptores de colecistoquinina e de
melanocortinas também têm sido estudados devido a seus papéis no
controle da depressão endógena. Este é um campo rico e ainda
relativamente pouco explorado no tratamento de distúrbios e
patologias do SNC.
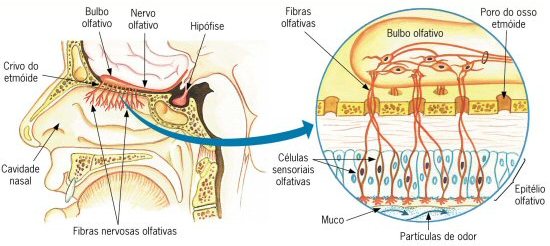
Como você já viu, o olfato é provavelmente o
sentido mais primitivo dos animais. A sensação do odor surge quando
moléculas voláteis, que são carreadas pelo ar até o interior do
nariz, dissolvem-se no muco presente na cavidade nasal e então
interagem com receptores localizados nas terminações nervosas do
epitélio olfativo, que difere do epitélio respiratório; este não é
inervado nem participa da aquisição das sensações olfativas. Clique
na figura abaixo para ver um vídeo sobre o olfato.
CLIQUE PARA VER A ANIMAÇÃO
Os receptores do epitélio olfativo possuem alta
especificidade de interação com as moléculas (ligantes) que causam a
sensação de odor; essa interação promove a produção de AMP cíclico
no neurônio, mas, neste caso, esse segundo mensageiro não irá
fosforilar proteínas citoplasmáticas, mas promoverá a abertura de um
canal iônico, o que levará à despolarização desse neurônio. Esse
impulso elétrico será conduzido pelo axônio neuronal até o encéfalo,
chegando a áreas como a amígdala (envolvida com a resposta emocional
ao odor) e o hipocampo (envolvido com a memória).
Os seres humanos, ao longo da evolução, tiveram
diminuição da sua capacidade olfativa, em comparação com outros
animais. Os cães, por exemplo, possuem uma área de epitélio olfativo
aproximadamente 10 vezes maior, além de possuir um maior número de
receptores por área. Mesmo outros primatas possuem o sentido do
olfato mais desenvolvido que os humanos; parece que
mutações em genes específicos são a causa dessa diferença. Os
estudos sobre a evolução dos primatas indicam que o olfato perdeu,
para a visão, o lugar de principal sentido para permitir realizar as
tarefas que garantiriam a manutenção da espécie, ou seja, obter
alimento e acasalar.

Os cães são animais macrosmáticos, enquanto os primatas, como
os gorilas, são microsmáticos. Os cetáceos, como a baleia, são
anosmáticos, por não possuírem aparelho olfativo.
Como ocorre com tantos outros temas, o sentido do
olfato também se tornou alvo de experimentos pseudocientíficos.
Algumas pessoas afirmam possuir “habilidade” paranormal de sentir
odores de lugares distantes (olfato
remoto), não só no espaço, mas também no tempo! Entretanto,
quando submetidos a ensaios controlados, não conseguem provar esta
“capacidade”. Este é um bom tema para você discutir com seus alunos:
a diferença entre ciência e pseudociência.
O paladar é o sentido que detecta o sabor
daquilo que comemos, ou, de forma mais geral, daquilo que entra
em contato com as papilas gustativas presentes na língua. Essas
papilas são formadas por células sensoriais que interagem com
moléculas presentes no alimento e dissolvidas na saliva ou nos
líquidos presentes na boca, gerando um impulso que será
conduzido até o encéfalo. Existem quatro tipos comprovados de
papilas gustativas, responsáveis pelas sensações de doce,
salgado, amargo e azedo (ácido), mas há discussões sobre a
existência de outros tipos, que seriam responsáveis pela
sensação de sabor de carne (umami) e pelo sabor associado
a ácidos graxos como o ácido linoleico (presente no óleo de
girassol, na forma de triglicerídeo). O umami, por sua
vez, seria provocado por ácido glutâmico, um aminoácido
dicarboxílico que também atua como neurotransmissor no SNC, além
de ser empregado como tempero para carnes (glutamato sódico). Os
vários tipos de papilas gustativas estão distribuídos por toda a
língua, sendo pequena a diferença de concentração desses
diferentes tipos em cada região da língua.
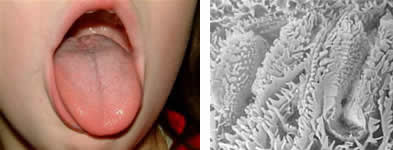
Língua humana e papilas gustativas de língua de macaco
(micrografia eletrônica de varredura)
Vários fatores afetam a sensação do paladar,
como a idade, variações hormonais, variações genéticas e
sensoriais (olfato e visão). Um exemplo de variação genética é a
capacidade de sentir o sabor amargo da feniltiouréia: cerca de
70% da população mundial é capaz de sentir seu sabor, enquanto
para os outros 30% ela é praticamente insípida. Essa taxa,
entretanto, varia em função da etnia da população; os ameríndios
são os mais sensíveis (98%). As mulheres também são, de modo
geral, mais sensíveis que os homens ao sabor desse composto.

Entretanto, uma simples modificação na sua
estrutura – a troca do átomo de enxofre por oxigênio – gera a
dulcina, um composto de sabor doce. Isso parece estar envolvido
com o tipo de interação entre esses compostos e os receptores
para sabores doce e amargo:

Modelo da interação entre o receptor (azul) e o
ligante (vermelho). O sítio X-H do receptor atua como doador de
hidrogênio para ligação de hidrogênio, enquanto o sítio Y atua
como doador de elétrons. Quando as interações de X-H e Y com
seus sítios complementares no ligante possuem forças
semelhantes, o composto é sentido como doce; se uma delas é mais
fraca que a outra, o sabor é percebido como amargo.
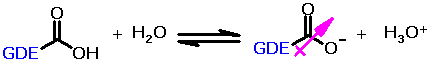
Na dulcina, o oxigênio da carbonila atua como doador
de elétrons, complementar ao sítio X-H do receptor, enquanto o
NH2 atua como doador de hidrogênio complementar a Y
no receptor. A distância correta entre esses grupos e a igual
força de interação deles com o receptor faz com que a dulcina
ative a sensação de doce.
Na feniltiouréia, o sítio complementar a X-H é uma
tiocarbonila (C=S). Como a interação entre X-H e S é mais fraca
que aquela entre N-H e Y, o sabor é percebido como amargo.
A necessidade de dissolução do composto em
água para que seu sabor possa ser sentido permite que possamos
alterar a solubilidade de uma substância para modificar seu
sabor. Por exemplo, o cloranfenicol, um antibiótico muito
utilizado, é extremamente amargo, sendo, assim, difícil o seu
uso por via oral. Sua conversão em um éster de ácido palmítico (palmitato
de cloranfenicol) faz com que ele se torne insolúvel em água, e
assim seu sabor amargo praticamente não é percebido, o que
permite seu uso em formulações orais.
O paladar, como vimos, é bastante associado
ao olfato. Além dos receptores do paladar e do olfato, o sabor
de um alimento também dependerá da estimulação de receptores de
frio, calor e dor, que são atribuições sensitivas do nervo
trigêmeo. Assim, é o conjunto da estimulação de receptores
olfativos, papilas gustativas e receptores do ramo mandibular do
nervo trigêmeo que irá criar no cérebro a sensação do sabor de
um alimento. O uso contínuo de estimuladores dos nociceptores do
trigêmeo levará à sua dessensibilização, como ocorre quando
usamos continuamente pimenta na alimentação: depois de algum
tempo, não sentimos mais seu sabor. Em certas culturas, como a
iorubá (da África Ocidental), é comum dar pimenta às crianças
desde a fase de colo, o que permite que consumam grandes
quantidades de pimenta quando adultos, muito acima do que outras
pessoas podem suportar.

O acarajé é uma comida de origem iorubá, e bem
temperado com pimenta!
Essa ativação do nervo trigêmeo explica
também por que a pimenta faz os olhos arderem: é a estimulação
dos nociceptores do ramo oftálmico do trigêmeo. Neste caso, a
defesa do organismo é fechar os olhos, numa resposta reflexa a
essa estimulação do trigêmeo, para diminuir o acesso da
substância irritante ao órgão que está sendo agredido.
Isso também explica por que fechamos os olhos
ao comermos algo muito temperado com pimenta: a estimulação do
ramo mandibular é registrada pelo encéfalo, que responde com
ações para as diversas regiões inervadas pelo trigêmeo, como a
dos olhos, onde a resposta é fechá-los.
O mentol e a cânfora, substâncias presentes
em diversas plantas, são capazes de ativar os receptores de frio
do trigêmeo, o que justifica o seu emprego em balas, outros
alimentos e em pastas de dentes, visando a causar a conhecida
sensação de ”refrescância”.
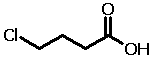
Os sentidos do paladar e do olfato, como você
viu, são sentidos químicos, ou seja, dependem da interação de
moléculas com receptores neuronais específicos. Dessa forma, as
sensações obtidas por esses sentidos são fortemente dependentes das
estruturas e das propriedades físico-químicas das moléculas que irão
ativá-los.
Em relação ao olfato, a principal propriedade
físico-química a ser estudada é a volatilidade dos componentes do
objeto que está sendo cheirado. Essa propriedade está diretamente
relacionada às interações entre as moléculas dessas substâncias, de
forma a permitir a passagem do estado líquido ou do estado sólido
para a fase gasosa (evaporação e sublimação, respectivamente) e ser
carreado pelo ar até os bulbos olfativos no interior do nariz.

Evaporação (http://www.flickr.com/photos/oldonliner/436326382/)
e
Sublimação (http://www.flickr.com/photos/slice/464646935/)
No sentido do paladar, a principal propriedade
físico-química envolvida é a solubilidade em água, que representa a
capacidade das moléculas de uma substância de formar interações com
moléculas de água (interações soluto-solvente) às custas das
interações entre as moléculas dessa mesma substância (interações
soluto-soluto) e entre moléculas do solvente.
Assim, para compreender como certas moléculas
conseguem ativar esses sentidos e outras não, é preciso compreender
essas interações intermoleculares. As mais importantes – e que
iremos discutir aqui – podem ser enquadradas em três categorias:
-
Ligações hidrogênio
-
Interações dipolo-dipolo
-
Forças de van der Waals
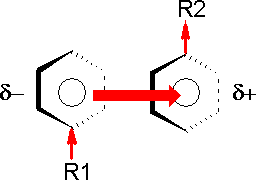
Outras interações menos discutidas são variações
das interações do tipo dipolo-dipolo, como a íon-dipolo e os
complexos de transferência de carga, também chamados de interações
do tipo π-stacking (a tradução
literal seria empilhamento de sistemas π),
em que um anel aromático, normalmente ligado a um grupo
eletrodeficiente (R2), funciona como dipolo positivo, e então forma
uma interação dipolo-dipolo com outro anel aromático ligado a um
grupo doador de elétrons (R1), porém de alta densidade eletrônica e
que atua como dipolo negativo. Esse tipo de interação é muito
importante no meio biológico, pois possibilita a interação entre os
anéis aromáticos presentes nas estruturas de diversos fármacos e os
anéis aromáticos de resíduos de aminoácidos como a tirosina e o
triptofano.
As ligações de hidrogênio (também chamadas
ligações hidrogênio) são interações intermoleculares que ocorrem
entre um átomo de hidrogênio com baixa densidade eletrônica em
uma molécula e um átomo de alta densidade eletrônica em outra
molécula.
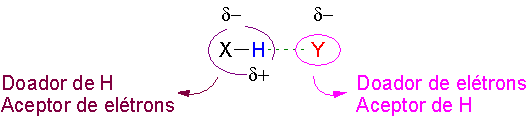
As ligações de hidrogênio mais fortes são
aquelas em que X e Y são átomos de alta eletronegatividade, como
flúor, oxigênio e nitrogênio (o tradicional FON dos livros de
Química), mas outros átomos podem participar, como enxofre,
cloro e até mesmo carbono, desde que outros átomos ligados a
este promovam um acentuado momento de dipolo, gerando uma forte
redução da densidade eletrônica do hidrogênio, como ocorre, por
exemplo, no clorofórmio. Este trihalometano pode interagir com
outras moléculas orgânicas, como a acetona e a piridina, através
desse tipo de interação.
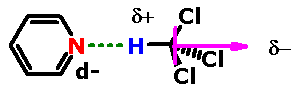
Além de ocorrer entre moléculas, também podem
existir ligações de hidrogênio intramoleculares, sendo mais
comuns quando ocorre a formação de um anel de 5 ou de 6 membros:

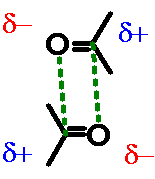
Por sua vez, as interações dipolo-dipolo
ocorrem entre dipolos de menor intensidade que aqueles
envolvidos na ligação de hidrogênio, como ocorre, por exemplo,
entre moléculas de acetona.
Por último, as forças ou interações de van
der Waals ocorrem entre dipolos muito fracos, como aqueles que
existem em cadeias hidrocarbônicas e que são gerados pelo
próprio movimento das nuvens eletrônicas. Esses dipolos podem
ser permanentes ou induzidos, como quando há a aproximação de um
átomo polar a uma cadeia hidrocarbônica.
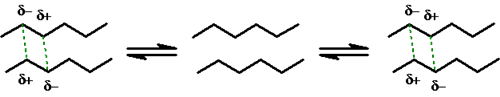
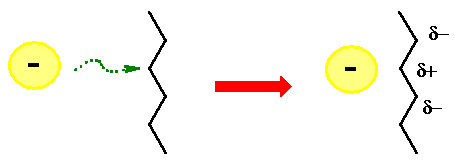
As interações de van der Waals, assim como as
ligações de hidrogênio, são na verdade casos especiais de
interações dipolo-dipolo. Enquanto as primeiras são interações
dipolo-dipolo muito fracas, estas últimas são muito fortes, o
que lhes confere esses nomes especiais. Entretanto, embora as
interações de van der Waals sejam isoladamente fracas, quando
temos uma cadeia hidrocarbônica longa ocorre a formação de
diversas interações deste tipo, e o somatório da energia
associada a cada uma delas pode sobrepujar até mesmo uma
interação do tipo ligação de hidrogênio.
Observe, no quadro a seguir, a comparação das
energias associadas a cada tipo dessas interações
intermoleculares e compare a ligação covalente.
| Tipo de ligação |
Energia (kJ/mol) |
| Ligação de hidrogênio |
10-40 |
| Dipolo-dipolo |
0,1-10 |
| van der Waals |
0,1-2,0 |
| Ligação covalente |
> 100 |
Como você pode ver, todas essas interações
intermoleculares são mais fracas que as ligações covalentes. O
somatório dessas interações intermoleculares define o grau de
coesão intermolecular de uma substância, e, assim, define a
energia necessária para separar as interações, como ocorre nas
mudanças de estado físico e na solubilização em água. Quanto
mais forte e maior o número dessas interações, mais difícil será
afastar as moléculas e promover a fusão, a evaporação e a
solubilização. Veja em seguida esses processos em detalhes.
Observe a tabela a seguir.
| Estrutura |
 |
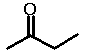 |
 |
| Nome |
n-Pentano |
Butanona |
1-Butanol |
| Peso molecular (u) |
72 |
72 |
74 |
| PE (oC) |
36 |
80 |
116 |
Nesta série de três compostos com pesos
moleculares muito próximos, observamos um aumento de ponto de
ebulição na seguinte seqüência: hidrocarboneto < cetona < álcool.
Isso ocorre devido à força das interações intermoleculares: nos
hidrocarbonetos, temos apenas forças de van der Waals atuando,
enquanto a coesão entre as moléculas de butanona é determinada por
interações dipolo-dipolo, requerendo, assim, mais energia térmica
para promover a separação das moléculas e a conseqüente mudança de
estado físico. O mesmo raciocínio é empregado para justificar o
maior ponto de ebulição do butanol, que, por ser um álcool, tem suas
moléculas unidas por ligações hidrogênio, além das interações de van
der Waals que ocorrem entre as cadeias hidrocarbônicas.
Veja esta outra tabela:
| Estrutura |
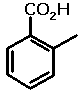 |
 |
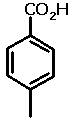 |
 |
| Nome |
Ácido o-toluico |
Ácido salicílico |
Ácido p-toluico |
Ácido p-hidroxibenzóico |
| PF (oC) |
102 |
157 |
177 |
213 |
Aqui você pode observar como a capacidade de
aproximação entre os grupos capazes de realizar ligações hidrogênio
intermoleculares determina o valor de ponto de fusão. No caso dos
ácidos o-toluico e salicílico, que possuem substituintes na
posição orto ao grupo ácido carboxílico, o ponto de fusão é
menor que seus isômeros em que esses grupos encontram-se na posição
para. Isso se dá pelo impedimento estérico (volume ocupado)
que esses grupos promovem ao redor da carboxila (CO2H),
dificultando a aproximação entre carboxilas de duas moléculas desses
ácidos, diminuindo assim a coesão intermolecular. Por outro lado, os
ácidos que possuem uma função hidroxila adicional (ácidos salicílico
e 4-hidroxibenzóico), também capazes de realizarem ligações
hidrogênio, possuem ponto de fusão mais elevado que os outros dois.
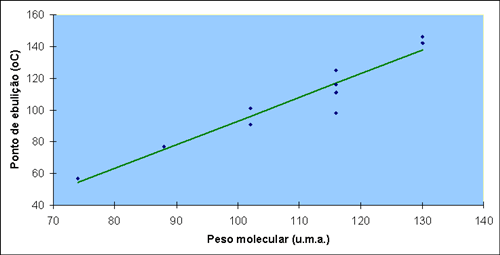
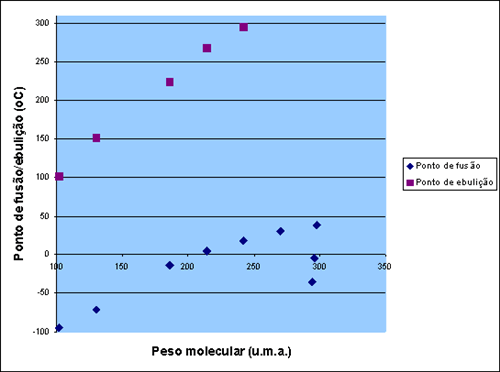
Veja outro exemplo de como os efeitos estéricos
podem afetar uma propriedade físico-química. No gráfico a seguir,
você encontra a correlação entre os valores de peso molecular e
ponto de ebulição de uma série de ésteres de ácidos acéticos
(acetatos), descritos na tabela posterior ao gráfico.
| Nome |
Estrutura |
Peso molecular (u) |
Ponto de ebulição (oC) |
| Acetato de metila |
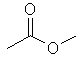 |
74 |
57 |
| Acetato de etila |
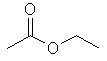 |
88 |
77 |
| Acetato de n-propila |
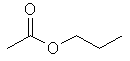 |
102 |
101 |
| Acetato de isopropila |
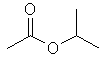 |
102 |
91 |
| Acetato de n-butila |
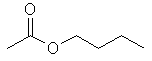 |
116 |
125 |
| Acetato de s-butila |
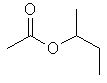 |
116 |
111 |
| Acetato de isobutila |
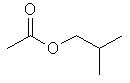 |
116 |
116 |
| Acetato de t-butila |
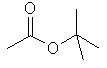 |
116 |
98 |
| Acetato de n-pentila |
 |
130 |
146 |
| Acetato de isopentila |
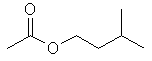 |
130 |
142 |
Observe que na seqüência dos ésteres de cadeia
linear existe uma correlação positiva entre os valores de ponto de
ebulição e o aumento da cadeia hidrocarbônica (linha vermelha), o
que pode ser explicado pelo aumento das interações intermoleculares
do tipo van der Waals. Entretanto, os ésteres de cadeia ramificada
fogem dessa reta, já que a ramificação dificulta a aproximação das
cadeias para que ocorra a formação de interações de van der Waals
mais efetivas (reflita: se essas interações são muito fracas,
pequenos aumentos na distância entre as cadeias causam redução
significativa da coesão intermolecular, reduzindo assim o ponto de
ebulição).
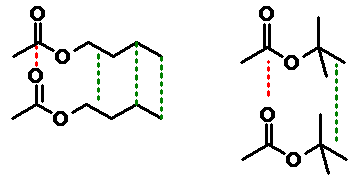
Situação semelhante pode ser observada em uma
série de ésteres metílicos de ácidos graxos: o aumento da cadeia
hidrocarbônica leva ao aumento dos valores de ponto de fusão e de
ebulição, mas a presença de insaturações leva a uma queda nestes
valores . Isso ocorre porque as ligações duplas das cadeias dos
ácidos graxos insaturados são regiões de alta densidade eletrônica,
e quando duas cadeias se aproximam a repulsão entre essas ligações
impede uma interação intermolecular maior.
| Nome |
Estrutura |
Peso molecular (u) |
Ponto de fusão (oC) |
Ponto de ebulição (oC) |
| Butirato de metila |
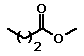 |
102 |
-95 |
102 |
| Caproato de metila |
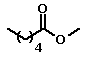 |
130 |
-71 |
151 |
| Decanoato de metila |
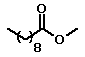 |
186 |
-14 |
224 |
| Laurato de metila |
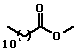 |
214 |
5 |
268 |
| Miristato de metila |
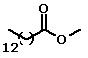 |
242 |
18 |
296 |
| Palmitato de metila |
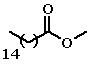 |
270 |
30 |
- |
| Estearato de metila |
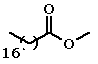 |
298 |
38 |
- |
| Oleato de metila |
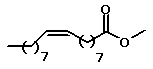 |
296 |
-5 |
- |
| Linoleato de metila |
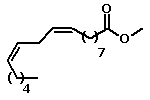 |
294 |
-35 |
- |
É por isso que, atualmente, existe uma
preocupação muito grande com o consumo de gorduras hidrogenadas:
elas são predominantemente saturadas, com alto grau de associação
intermolecular, o que pode levar a doenças, além de diminuir a
fluidez da membrana celular. Essa propriedade de fluidez da membrana
plasmática, fundamental para a manutenção da vida, é dependente da
presença de insaturações nas moléculas dos ácidos graxos que
constituem a sua bicamada fosfolipídica. Será que seus alunos
imaginam que a Química pode explicar algo tão fundamental para a
manutenção das condições de saúde deles?
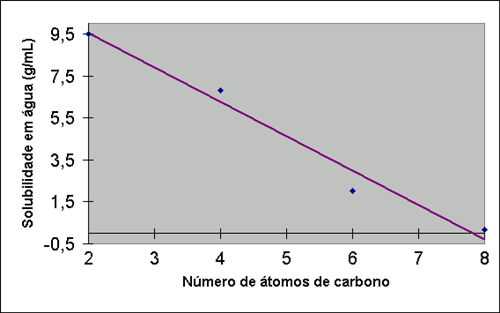
Analise a propriedade da solubilidade em água.
Veja a tabela e o gráfico a seguir:
| Estrutura |
HO2CCO2H |
HO2C(CH2)2CO2H |
HO2C(CH2)4CO2H |
HO2C(CH2)6CO2H |
| Nome |
Ácido oxálico |
Ácido succínico |
Ácido adípico |
Ácido subérico |
| Peso molecular (u) |
90 |
118 |
146 |
174 |
| Solubilidade em água(g/100 mL) |
9,5 |
6,8 |
2 |
0,16 |

Nesta série de ácidos dicarboxílicos, você pode
perceber que a solubilidade em água diminui com o tamanho da cadeia
hidrocarbônica. Isso pode ser explicado assim:

Antes de ocorrer a solubilização, as moléculas do soluto
estão unidas por ligações de hidrogênio (verde) e interações de van
der Waals (azul), enquanto as moléculas de água interagem entre si
por ligações hidrogênio (verde).

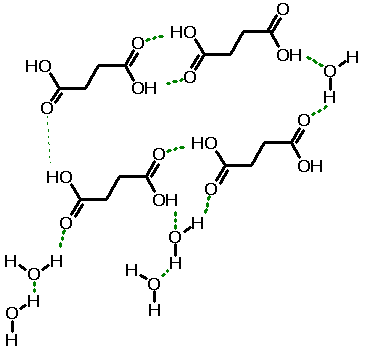
No início do processo de solubilização, é necessário que
ocorra a quebra de interações soluto-soluto (ligações hidrogênio e
van der Waals) e solvente-solvente (ligações hidrogênio) e se inicie
o processo de formação de interações soluto-solvente (ligações
hidrogênio).

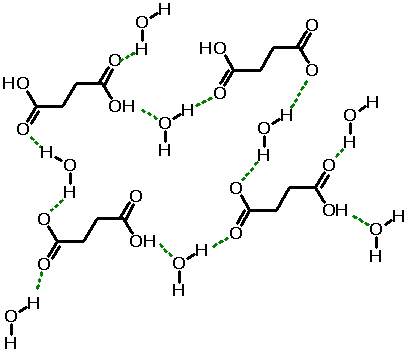
Ao final desse processo, as interações soluto-soluto estão
rompidas, e todas as moléculas do soluto estão interagindo com
moléculas de solvente. Conseqüentemente, para que o processo de
solubilização ocorra, é necessário que a energia associada à
formação das interações soluto-solvente compense a energia gasta na
quebra das interações soluto-soluto e solvente-solvente. Quando
ocorre o aumento da cadeia hidrocarbônica, isso não ocorre, já que
não há formação de interações entre a água e a cadeia (na verdade,
ocorre repulsão), e a energia associada às ligações hidrogênio
soluto-solvente não compensa essa repulsão nem a quebra das
interações soluto-soluto e solvente-solvente.
A polaridade da molécula também é importante para
a sua solubilização em água. Veja o caso de dois ácidos isoméricos,
os ácidos maléico e fumárico:
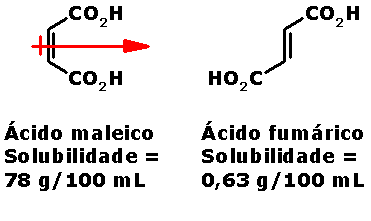
Devido à sua geometria, o ácido maléico apresenta
um momento de dipolo diferente de zero (representado pela seta
vermelha), o que faz com que ele possua alta solubilidade em água.
Já o ácido fumárico é muito pouco solúvel, porque o momento de
dipolo é zero nesta molécula, já que o vetor de momento de dipolo de
uma carboxila é cancelado pelo da outra carboxila.
Outra propriedade importante para o sentido
do paladar é o caráter ácido-base dos compostos orgânicos. Em
Química Orgânica utilizamos principalmente as teorias de
Bronsted-Lowry e de Lewis sobre acidez e basicidade; assim, o
ácido acético é tipicamente um ácido em meio aquoso, já que
tende a doar [H+] para a base (água), formando a base
conjugada (acetato),
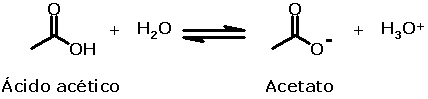
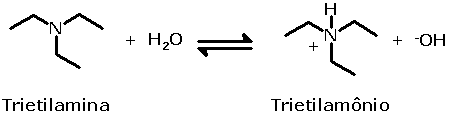
enquanto a trietilamina se comporta como base
nesse mesmo solvente, por doar um par de elétrons, o que
corresponde a receber [H+].
Entretanto, em outros solventes, essas mesmas
espécies podem ter comportamentos opostos, como acontece com o
ácido acético na presença de ácido sulfúrico concentrado.

Como a estrutura influencia a
acidez/basicidade de um composto? Os grupos ligados ao sítio
ionizável podem modular essas propriedades através de três
efeitos diferentes:
a. Efeito indutivo
Este é um efeito eletrônico que se transmite
ao longo das ligações σ. Através
dele, átomos eletronegativos retiram (“puxam”) elétrons do sítio
ionizável, enquanto cadeias hidrocarbônicas doam elétrons. No
caso dos ácidos, os grupos que retiram elétrons (GRE) diminuem a
densidade eletrônica do carboxilato, aumentando sua
estabilidade:

Quanto mais estável for a base conjugada,
maior a acidez do ácido correspondente. Seguindo o mesmo
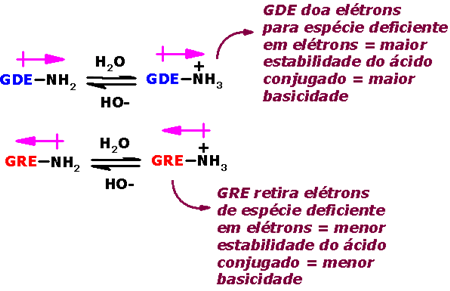
raciocínio, grupos doadores de elétrons (GDE) irão diminuir a
acidez, por aumentar a densidade eletrônica do carboxilato,
diminuindo sua estabilidade.
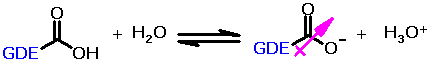
Para as bases, ocorre o efeito inverso: os
GDE aumentam a densidade eletrônica do sítio básico, favorecendo
sua capacidade de doar um par de elétrons, enquanto os GRE
diminuem-na, levando então a uma base mais fraca:

O efeito indutivo se perde muito rapidamente
com o aumento do número de ligações σ
entre o sítio ionizável e os GDE/GRE. Veja um exemplo:
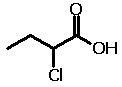
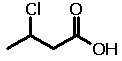
| Estrutura |
 |
 |
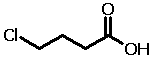 |
| Nome |
Ácido 2-clorobutírico |
Ácido 3-clorobutírico |
Ácido 4-clorobutírico |
| pKa |
2,86 |
4,05 |
4,52 |
Veja como o valor de pKa (constante que mede
a acidez de um composto) aumenta com o distanciamento do grupo
GRE (Cl) do sítio ionizável (CO2H). Isso ocorre em
função da redução do efeito indutivo com o aumento dessa
distância.
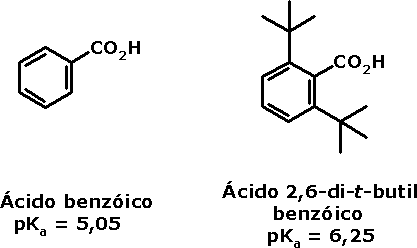
b. Efeito estérico
Esse efeito é exercido por átomos ou grupos
volumosos. Ele dificulta a aproximação da espécie que reage com
o ácido ou base orgânica; assim, o efeito estérico sempre leva a
uma redução da acidez ou da basicidade:
c. Efeito de ressonância
Esse efeito eletrônico, ao contrário do
efeito indutivo, não se dá ao longo das ligações
σ, mas envolve as ligações
π e elétrons em orbitais n,
desde que essas ligações e os elétrons n estejam em
orbitais paralelos que possam se conjugar:
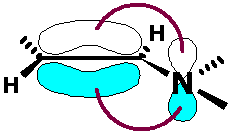
Podemos representar este efeito através das
formas de ressonância do composto:
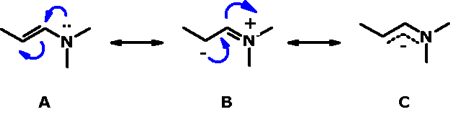
Nesse esquema, A e B são formas
de ressonância da N,N-dimetil-2-propenamina (N,N-dimetilalilamina).
Embora A seja a forma que melhor representa esse
composto, por não haver separação de cargas, algumas das
propriedades eletrônicas desta amina podem ser explicadas pela
forma de ressonância B. Nenhuma das duas formas de
ressonância corresponde ao composto real, que é mais bem
representado pelo somatório das propriedades eletrônicas de cada
forma de ressonância; esse somatório é o híbrido de
ressonância, representado no esquema por C. Não
esqueça que A e B não existem; logo, não há
equilíbrio entre as formas de ressonância (veja que a seta
utilizada entre elas é uma seta de duas pontas e não duas setas
em sentidos opostos!). Ao desenhar formas de ressonância,
estamos desenhando, de certa forma, um mapa da distribuição
eletrônica do sistema π de uma
molécula; assim, apenas elétrons se movem, e os núcleos atômicos
permanecem imóveis nas diversas formas de ressonância.
O efeito de ressonância permite o
espalhamento de elétrons ao longo de vários átomos na estrutura
do composto, levando a uma redução da densidade eletrônica. No
caso dos ácidos, isso favorece a acidez, por aumentar a
estabilidade da base conjugada; no caso das bases, essa redução
da densidade eletrônica tende a diminuir a basicidade do
composto. O efeito de ressonância geralmente predomina sobre os
demais efeitos estereoeletrônicos.
Nas aulas sobre ácidos carboxílicos
(vinagre), aminas (pimenta) e fenóis (canela), discutiremos mais
profundamente as conseqüências do efeito de ressonância sobre a
acidez e a basicidade dos compostos orgânicos.
O efeito de ressonância também explica por
que os ácidos carboxílicos são mais ácidos que os álcoois. A
base conjugada dos ácidos carboxílicos (carboxilato) é
estabilizada por ressonância, levando à distribuição do par
eletrônico entre dois átomos de oxigênio:

No caso dos alcóxidos (bases conjugadas dos
álcoois), como não há ressonância, o par eletrônico advindo da
quebra da ligação O-H fica concentrado no átomo de oxigênio,
diminuindo assim a estabilidade da base conjugada e,
conseqüentemente, reduzindo a acidez dos álcoois em comparação
aos ácidos carboxílicos:

Aprofundando o Assunto
|
o corpo humano é uma central
de análises!
Em
menos de um segundo somos capazes de detectar, no
ar, a presença de substâncias em concetrações tão
baixas que nenhuma máquina construída pelo homem
detectaria.
O olfato é o mais antigo - e um dos mais intrigantes
- sentidos desenvolvidos pelo homem. Neste artigo
você vai saber um pouco mais sobre o olfato,
quimiossensores e a relação entre a estrutura da
molécula e o odor experimentado.
|
Estrutura Química vs. Odor |
Moléculas com estrutura química muito
semelhantes podem apresentar odores
completamente distintos.
Veja os exemplos abaixo:
|
|
maçã
|
|
|
manteiga rançosa
|
|
|
alho
|
|
|
cebola
|
|
|
alho
|
|
|
vinho
|
|
|
whiskey
|
|
|
pipoca
|
|
|
banana
|
|
|
limão
|
|
|
menta
|
|
|
cravo
|
|
|
jasmim
|
|
|
rosa |
|
|
morango
|
|
O olfato depende de receptores sensoriais que
respondem à presença de certas moléculas na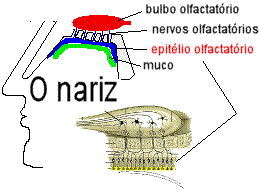 atmosfera. Nos humanos, estes quimiorreceptores
estão localizado no epitélio oftactatório -
um pedaço de tecido do tamanho de um selo postal,
localizado na cavidade nasal.
atmosfera. Nos humanos, estes quimiorreceptores
estão localizado no epitélio oftactatório -
um pedaço de tecido do tamanho de um selo postal,
localizado na cavidade nasal.
Este tecido é recoberto de cílios e uma camada de
muco. As moléculas gasosas são dissolvidas no
muco e, então, interagem com os receptores. Isto
ativa uma enzima, a adenilil ciclase, que
cataliza a conversão de ATP ao AMP cíclico (cAMP). O
cAMP ativa um canal de Na+, gerando um
potencial de despolarização ao longo da membrana.
Este impulso é
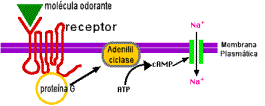 transmitido
pelos nervos olfactatórios até o cérebro, que,
computando outros estímulos sensoriais, interpreta o
impulso como um odor - muitas vezes acionando áreas
da memória que relacionam o particular odor com algo
já experimentado antes. transmitido
pelos nervos olfactatórios até o cérebro, que,
computando outros estímulos sensoriais, interpreta o
impulso como um odor - muitas vezes acionando áreas
da memória que relacionam o particular odor com algo
já experimentado antes.
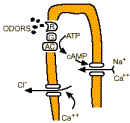
A substância odorante precisa ter certas
propriedades para ser capaz de provocar alterações
sensoriais: deve apresentar alguma solubilidade em
água, pressão de vapor considerável, lipofilicidade,
e massa molar não muito elevalda (em um artigo de
1967, Demole e Wuest, na Helv. Chem. Acta.,
garantem não existir nenhuma molécula odorante com
massa molar maior do que 294 g/mol). Existem
cerca de 50 milhões de células receptoras em cada
uma das duas cavidades nasais. O ser humano é capaz
de distinguir mais de 10.000 espécies químicas
diferentes, baseado apenas em sua estrutura
molecular.
Uma comparação das estruturas das moléculas com seus
odores revela algumas similaridades: por exemplo,
substâncias com odor de peixes geralmente contém
um átomo de nitrogênio ligado a 3 átomos, com um par
eletrônico não-ligante: são aminas primárias,
secundárias ou terciárias, tal como dietilamina, H3C–NH–CH3
e etilamina, H2N–CH2CH3.
A indústria alimentícia tem particular interesse em
substâncias odorantes. Os grupos mais utilizados
comercialmente são os ésteres e as gama e delta
lactonas.
Diversos grupos de pesquisa no Brasil estudam
compostos que apresentam odores ou aromas. Este é um
campo promissor, pois a indústria alimentícia
depende de nós, químicos, para a obtenção de
compostos que confiram aos seus produtos os sabores
desejados.
|
algumas lactonas e seus
odores
|
|
|
chocolate |
|
|
creme |
|
|
côco
|
|
|
pêssego |
|
|
gordura |
|
|
jasmim |
|
Receptores Sensoriais
|
A entrada de informação no sistema
nervoso central é dada pelos
receptores sensoriais. Existem
basicamente cinco tipos diferentes
de receptores sensitivos:
1)
mecanorreceptores: detectam
deformações mecânicas dos receptores
ou de células adjacentes;
2)
termorreceptores:
detectam alterações da temperatura -
alguns detectam o frio e outros o
calor;
3)
eletromagnéticos:
detectam a luz na retina
4)
nociceptores: detectam lesões
nos tecidos tanto físicas quanto
químicas
5)
quimiorreceptores:
detectam paladar e olfato, nível de
oxigênio no sangue arterial, pressão
osmótica dos líquidos corporais,
concentração de CO2,
glicose, aminoácidos, entre outros. |
|
Você sabia?
As células do paladar e do olfato são as únicas do
sistema nervoso que são substituídas
quando velhas ou danificadas.
Existem várias doenças associadas ao paladar
e olfato, tal como a anosmia, que
caracteriza-se pela perda completa do olfato, ou a
ageusia, que corresponde à perda total do
paladar. As maiores
 causas
são infecções no trato nasal, distúrbios hormonais
ou problemas com os dentes causas
são infecções no trato nasal, distúrbios hormonais
ou problemas com os dentes
Existem basicamente três sistemas de
quimiossensores no nariz e na boca. O primeiro,
do olfato, confere a habilidade de identificar
odores. O segundo, do paladar, detecta o sabor, tal
como doce, amargo e azedo.
E, finalmente, existe um tipo especial de células
quimiossenssoras, localizadas na superfície do
olho, gartanta, boca e nariz, que detectam a
presença de substâncias irritantes, tais como
amônia, mentol e pimenta.
Umas das formas pela qual a respiração é
controlada é através de quimiorreceptores. Existem
dois tipos de quimiossensores respiratórios:
os arteriais
|
Nariz Artificial
|
|
Imagine a seguinte cena: você chega em casa
e um display de cristal líquido, na porta da
geladeira, lhe informa que o pêssego vai
estragar em dois dias e que o presunto já
estragou. Ficção? Não, basta colocar um
nariz eletrônico dentro do refrigerador!
Um dispositivo eletrônico coberto de
sensores químicos que, tal como nosso nariz,
é capaz de distinguir moléculas pelo seu
odor. Não existe, ainda, algo tão bom como
nosso nariz no mercado. Mas os "narizes
eletrônicos" disponíveis já são capazes de
fazer análises qualitativas e quantitativas
de várias substâncias, e já estão atuando em
diversas indústrias.

Algumas vezes menor do que um telefone celular, um nariz artificial pode ser
utilizado na indústria automobilística (pode
detectar o vazamento de fluídos e/ou o
início de um incêndio, pelo odor),
alimentícia (pode analisar a qualidade do
alimento pelo odor), na polícia (robôs
farejadores de drogas e explosivos), na
aeronáutica (pode alertar sobre possíveis
panes ou incêndio), entre outros. Os
sensores químicos são, em geral,
dispositivos a base de
polímeros condutores.
celular, um nariz artificial pode ser
utilizado na indústria automobilística (pode
detectar o vazamento de fluídos e/ou o
início de um incêndio, pelo odor),
alimentícia (pode analisar a qualidade do
alimento pelo odor), na polícia (robôs
farejadores de drogas e explosivos), na
aeronáutica (pode alertar sobre possíveis
panes ou incêndio), entre outros. Os
sensores químicos são, em geral,
dispositivos a base de
polímeros condutores. |
, que detectam mudanças na pressão parcial de O2
e CO2 no sangue arterial e os centrais
que detectam mudanças na pressão parcial de O2
e CO2 no cérebro.
O estímulo de tais sensores, causado por hipoxia
(aumento da pressão parcial de CO2),
provoca uma elevação do número de inspirações por
minuto, assim como na profundidade da respiração, o
que leva a um aumento da concentração de O2
e uma diminuição do estímulo ao receptor.
Dois químicos,
John McDevitt e Eric Anslyn, trabalhando com um
engenheiro de computação em Austin, na Texas
University, construiram um chip microscópico que
atua como um quimiossensor de paladar - uma
língua artificial. Seu trabalho está no
Journal of America Chemical Soc. de 1998,
na página 6429. A língua eletrônica possui centenas
de micro-esferas que mudam de cor, dependendo do
"sabor" da molécula analisada. O produto pode ser
utilizado na medicina, para testar colesterol no
sangue, para cientistas analisarem águas poluídas, e
como degustadores de comidas e bebidas nas
indústrias alimentícias. Utilizando uma "saliva"
química, a língua eletrônica será capaz mesmo de
"provar" substratos sólidos, como uma pedra, garante
McDevitt.
O composto terc-butil mercaptan, (CH3)3C–SH,
é um dos materiais, juntamente com sulfeto de
dimetil, CH3–S–CH3,
adicionado ao gás natural nos butijões, para
produzir um odor característico em caso de
vasamento.
|
Apenas 5 Sabores
|
Somos capazes de distinguir apenas cinco
sabores: salgado, doce, amargo, azedo e
umami. Veja como:
Sabor Salgado:
O sal é o cloreto de sódio (Na+Cl-).
O Na+ entra nas células
receptoras via canais de sódio, causando uma
despolarização, que se propaga pelo nervo
aferente primário.
Sabor Azedo:
A espécie detectada é o íon H+.
Os íons H+ bloqueiam a entrada
dos canais de potássio (K+).
Estes canais são responsáveis por manter a
célula num nível de hiperpolatização; o
bloqueio destes canais causa uma
despolarização, transmitida pelo nervo
aferente primário.
Sabor Doce:
Existem receptores na membrina apical que
ligam-se a glucose (sucrose e outros
carbohidratos). A ligação ao receptor ativa
a enzima adenilil ciclase, elevando a
concentração de cAMC, que causa uma inibição
dos canais de potássio, conduzindo a uma
despolarização da célula.
Sabor Amargo:
Substâncias amargas provocam uma liberação
de Ca2+ mediada pelo segundo
mensageiro (IP3). A elevação da [Ca2+]
provoca uma despolarização, transmitida pelo
nervo primário aferente.
Sabor Umami:
É o sabor de certos amino-ácidos (e.g.,
glutamato, aspartato, entre outros).
Recentemente, Chaudhari et al. publicaram um
artigo no Journal of Neuroscience
oferencendo um mecanismo para a ação do
glutamato monossódico no paladar. Este
composto é utilizado como aditivo pela
indústria alimentícia para "realçar" o sabor
dos alimentos. Os autores demonstraram que
há um receptor, o mGluR4, que media o sabor
umami. A ligação a este receptor ativa uma
proteína G que eleva a [Ca2+].
Além deste, existem receptores ionotrópicos
(ligados a canais iônicos) que são ativados
por substâncias umami. Isto provoca a
abertura não seletiva de canais iônicos,
aumentando o disparo no nervo primário
aferente. |
|
|
Home | Alimentos Transgênicos | Utensílios de Cozinha | Canela | Química dos Sentidos | Alho | Vinagre | Óleos Essenciais | Batata Diet | Aditivos Alimentares | Frutas e Frutos | Abacaxi | Fat Free | Tire sua dúvida | Cebola | Açúcar | Pimenta | Banana | Sal
Este site foi atualizado em
18/01/11
|