Por que os átomos estabelecem
ligações químicas? Esta é uma boa pergunta para
começar a explicar a formação do cloreto de
sódio. De maneira geral, para que uma ligação
química se estabeleça entre dois átomos, deverá
ocorrer um nítido decréscimo na energia do
sistema, isto é, para que ocorra a reação geral
A(g) + B(g)
® AB(g),
deve haver liberação de energia. Contudo, nem
sempre as reações ocorrem desta forma. Há casos
em que mesmo havendo uma absorção de energia, ao
invés de uma liberação, a reação química
acontece de forma espontânea em função da maior
entropia[3] do sistema. Mas isto será visto com
mais detalhes a seguir.
A matéria é, em última
análise, constituída por entidades que
apresentam atrações ou repulsões mútuas, ou
seja, núcleos e elétrons. Os núcleos têm carga
relativa positiva, pois neles estão localizados
os prótons; os elétrons, distribuídos ao redor
do núcleo, têm carga relativa negativa. Logo,
compostos constituídos por dois ou mais núcleos
e elétrons apresentam uma estrutura que está sob
a ação de forças atrativas e repulsivas.
Vemos assim que a força
resultante sobre os núcleos e elétrons nos
compostos deve ser, como resultado de um balanço
entre as atrações e repulsões, nula. No entanto,
se as partículas forem levemente deslocadas de
suas posições de equilíbrio, devem aparecer
forças atrativas que restauram o equilíbrio.
Deste modo, o composto se mantém estável. A
expressão “ligação química” é simplesmente o
nome dado a esta força atrativa que aparece
quando tentamos afastar as partículas de sua
posição de equilíbrio.
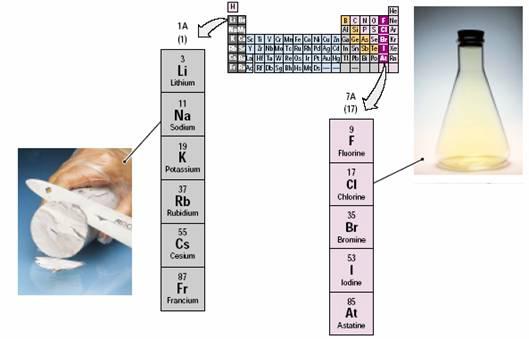
Figura 3
– Elementos que constituem o cloreto de sódio
Os termos “cloreto de sódio”
e “sal” estão sendo utilizados indistintamente
neste artigo, conforme foi destacado na
introdução. Neste ponto, reconheço a necessidade
de explicar esta distinção. O termo “sal” na
química diz respeito aos compostos capazes de se
dissociarem na água liberando íons, mesmo que em
pequena porcentagem, dos quais pelo menos um
cátion é diferente de H3O+
e pelo menos um ânion é diferente de OH-.
Com base nesta definição, o cloreto de sódio é
um sal. Contudo, o sal de cozinha não é um
“sal”. Por quê? Pois o sal de cozinha não é
constituído apenas por cloreto de sódio, mas
também, segundo a lei brasileira, deve ter um
teor igual ou superior a 40 miligramas até o
limite máximo de 100 miligramas de iodo por
quilograma de cloreto de sódio.
O sal é um composto
constituído pelos elementos sódio e cloro. O
primeiro pertence à família dos metais alcalinos
da tabela periódica, já o segundo pertence à
família dos halogênios (veja Figura 3).
Em termos de eletronegatividade, temos os
valores de 3,19 e 0,93 para o cloro e o sódio,
respectivamente, com base na tabela elabora pelo
químico Linus Pauling. Devido à diferença de
eletronegatividade ser maior que 1,7 (3,19 –
0,93 = 2,26), a ligação química entre o sódio e
o cloro assume um caráter predominantemente
iônico, isto é, um elétron do átomo sódio é
‘transferido’ para o átomo de cloro, e ambos
assumem uma configuração eletrônica estável
semelhante a de um gás nobre (veja Figura 4).
Cada elemento tem um
determinado valor de eletronegatividade,
propriedade que podemos relacionar com a
tendência que um átomo possui de atrair elétrons
para perto de si quando se encontra ‘ligado’ a
outro átomo de elemento químico diferente, em
uma substância composta. Não há sentido falar no
efeito da eletronegatividade em substâncias
simples, como o gás cloro (Cl2(g))
por exemplo, visto que ambos os átomos de cloro
possuem a mesma eletronegatividade, não havendo
deslocamento da ligação para um átomo em
detrimento do outro.
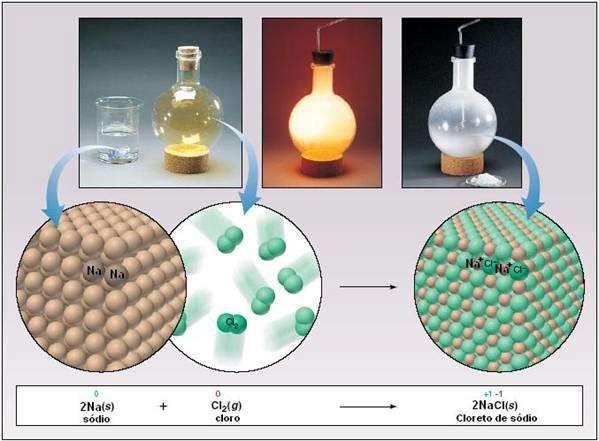
Figura 4
– O sódio e o cloro estabelecem uma ligação
iônica e formam o cloreto de sódio
Ao proporcionarmos o contato entre os dois
elementos no seu estado fundamental, ocorre uma
reação espontânea de formação do cloreto de
sódio. Por que isto ocorre? A termodinâmica[4]
explica.
Por evento espontâneo
entende-se aquele que ocorre independentemente,
sem uma assistência externa. Contudo, ser
espontâneo não significa que o evento é
instantâneo. Além disso, há também eventos
não-espontâneos. Como exemplo, citarei o caso da
parede de tijolos. Um monte de tijolos se tornar
uma parede não é um evento espontâneo. Podemos
passar pelo monte de tijolos pela manhã e, na
tarde do mesmo dia, ao passarmos novamente por
ele, estará imóvel. Para que o monte de tijolos
se torne uma parede há a necessidade da
intervenção de um pedreiro, ou seja, é preciso
um fornecimento de energia externa ao sistema.
Mas, o que tudo isso tem a
ver com a formação do cloreto de sódio? Não é
objetivo fazer aqui uma revisão sobre a
termodinâmica. Contudo, de maneira bastante
sintética, tentarei explicar porque a reação de
sódio metálico com cloro gasoso produzindo
cloreto de sódio é espontânea, conforme
representado na Figura 4.
Para que um evento seja
espontâneo o valor da energia livre (energia
livre de Gibbs) do sistema tem que ser negativa.
Essa energia é calculada segundo a equação
termodinâmica:
ΔG
= ΔH - T.ΔS
(1)
A energia livre é resultado
da interação da variação da entalpia (ΔH)
com a variação da entropia (ΔS),
sob efeito da temperatura (T). No caso do
cloreto de sódio, há uma diminuição da entropia,
isto é, há uma organização maior do produto em
comparação aos reagentes. Este aspecto não
colabora para um processo espontâneo. Por quê?
Perceba na equação (1) que quanto menor for o
valor de ΔS,
maior será a tendência do valor de
ΔG ser
positivo. Essa diminuição da entropia pode ser
notada pela soma dos mols dos reagentes em
comparação a do produto.
1 Na(s)
+ ½ Cl2(g) ®
1 NaCl(s) (2)
Como podemos ver na equação
(2), um mol de sódio somado a um mol de cloro
resulta em um mol de cloreto de sódio. Nota-se
uma organização do sistema, onde dois mols de
reagentes produziram um mol de produto. Não
obstante, a liberação de energia (ΔH)
é relativamente grande, garantindo o valor
negativo de ΔG
e explicando o caráter espontâneo da reação.
Existem diversas entalpias a
serem consideradas na formação do cloreto de
sódio, quando os elementos sódio e cloro estão
em seus estados fundamentais. O ciclo de
Born-Haber é um modelo que procura prever o
valor da energia liberada ou absorvida na
reação. Para conhecer os detalhes do ciclo de
Born-Haber, clique
aqui.
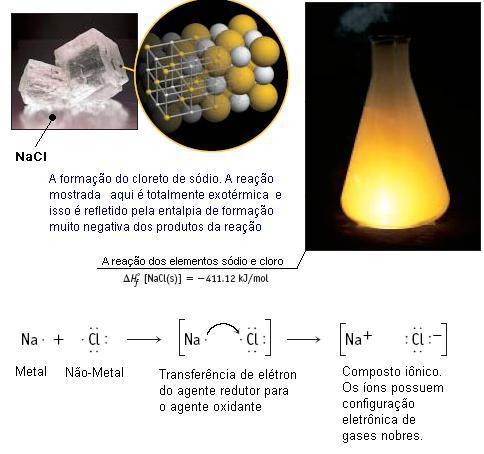
Figura 5
– Formação do cloreto de sódio – um processo
espontâneo.
A reação de formação do
cloreto de sódio é exotérmica, ou seja, libera
energia durante a reação. Isso nos permite
inferir que a energia dos produtos é menor que a
dos reagentes e, mesmo havendo uma maior
organização (menor entropia), a reação se dá de
forma espontânea devido ao processo ser
relativamente muito exotérmico. Detalhes da
reação com as estruturas de Lewis podem ser
observados na Figura 5.
O cloreto de sódio é um
sólido iônico. Portanto, há interações de
atração e repulsão entre as cargas dos íons.
Existe uma propriedade nos sólidos chamada
“número de coordenação”, a qual representa o
número de íons que circunda um outro íon. No
caso do NaCl(s), o número de
coordenação do íon Na+ é igual ao o
íon Cl-, visto que há uma relação de
1:1 entre eles.

Figura 6
– Configuração octaédrica do cloreto de sódio
A estrutura dos sólidos
iônicos pode ser explicada considerando-se os
tamanhos (raios) relativos dos íons positivos e
negativos. Cálculos geométricos simples permitem
determinar quantos íons de um dado tamanho podem
se arranjar em torno de outro íon.
No cloreto de sódio, a
relação de raios iônicos é igual a 0,52 e sugere
um arranjo octaédrico[5],
conforme pode ser visto na Figura 6. Note
que cada íon está rodeado por outros seis íons
de carga oposta. Contudo, para fazer estes
cálculos, é necessário admitirmos algumas
idealizações. Por exemplo, consideram-se os íons
como esferas rígidas e elásticas; a ligação
entre os íons seriam 100 % iônicas; os raios dos
íons são exatos, dentre outras. Não obstante,
mesmo sabendo que essas propriedades não são
exatas dessa forma, idealizações são necessárias
para obtermos resultados relativamente próximos
ao real.
Outro aspecto que permite que
o sal esteja presente na cozinha é a sua
solubilidade no considerado solvente universal:
a água. A solubilização do sal gera os íons Na+
e Cl-, conforme representado na
Figura 7.
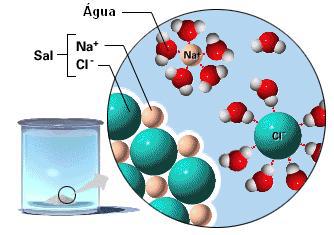
Figura 7
– Solubilidade do cloreto de sódio em água
A solubilidade de
substâncias, de maneira geral, se dá em função
de uma afinidade eletrônica existente entre as
espécies em um sistema. Esta afinidade pode ser
expressa na famosa frase: "Semelhante dissolve
semelhante". A questão é: Semelhante em que
aspecto? Para responder a esta pergunta devemos
fazer uma análise da estrutura molecular das
substâncias envolvidas.
Um cubo de açúcar contém
muitas moléculas e elas são mantidas unidas
pelas ligações de hidrogênio[6].
Quando um cubo de açúcar dissolve, cada molécula
permanece intacta. A molécula estabelece
ligações intermoleculares com as moléculas de
água e desfaz as ligações de hidrogênio com as
outras moléculas de açúcar. Por outro lado, o
sal em solução transforma-se em íons, como o
cátion Na+ e o ânion Cl-.
A solubilidade do cloreto de sódio só é possível
devido a afinidade eletrônica existente entre o
soluto (sal) e o solvente (água).
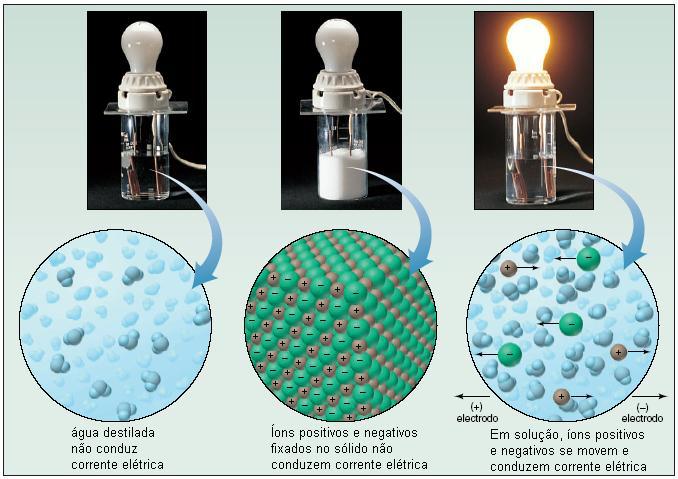 Figura
8 – Experimento que
mostra a ionização do sal em água.
Figura
8 – Experimento que
mostra a ionização do sal em água.
Uma experiência possível de
ser realizada até em sala de aula é a
representada pela Figura 8. A água
destilada é um mal condutor de eletricidade.
Porém, ao adicionarmos cloreto de sódio
(preferivelmente em água quente ou morna para
aumentar a solubilidade do sal), ocorre a
solubilização do mesmo e a conseqüente condução
elétrica. O fenômeno macroscópico que nos indica
isto é o acendimento da lâmpada de
incandescência. Por que a lâmpada acende? Devido
aos íons presentes na solução, os quais servem
como uma espécie de ‘ponte’ que leva os elétrons
a se moverem na solução e chegarem aos pólos
positivo e negativo.

[3]
Entropia: (1)A
grandeza física que descreve a
capacidade de um sistema para realizar
trabalho. (2) A propriedade
que descreve a desordem de um sistema.
[4]
Termodinâmica: Capítulo da
Física/Química que estuda a relação
entre o calor e outras formas de
energia, os processos de transformação
de energia e o comportamento dos
sistemas nestes processos.
[5]
Octaédrico: Uma configuração
semelhante a um sólido de oito faces.
[6]
Ligação de hidrogênio: Interação
intermolecular entre o hidrogênio e um
elemento com elevada eletronegatividade,
como o flúor, oxigênio e nitrogênio