 SUBSTITUIÇÃO
EM ALCANOS
SUBSTITUIÇÃO
EM ALCANOS
Substituição em Alcanos
Os alcanos são hidrocarbonetos
alifáticos saturados de fórmula geral: CnH2n+2.
São conhecidos como parafinas (do latim parum affinis, “pouca
afinidade, isto é, pouco reativo) porque apresentam fraca tendência a se
combinarem.
Nos alcanos existem apenas
ligações covalentes C – C e C – H, a estrutura dos carbonos é tetraédrica
e os ângulos de ligação são de 109°28’.
Vamos recordar alguns alcanos:
CH4 Metano (gás dos pântanos)
H3C __ CH3 Etano
H3C __ CH2__
CH3 Propano
H3C __ CH2__
CH2__ CH3 Butano
Propriedades Físicas dos Alcanos
O ponto de ebulição aumenta de
20 a 30 °C para cada carbono adicionado à cadeia. Em condições ambientais
verificam-se os três estados físicos: gases (de 1 a 4 carbonos), líquidos
(de 5 a 18 carbonos) e sólidos (mais de 18 carbonos).
No caso dos alcanos isômeros,
quanto mais ramificada a cadeia, mais baixo o ponto de ebulição.
O ponto de fusão aumenta com o
tamanho da cadeia carbônica, porém esse aumento não é muito regular como o
ponto de ebulição.
Para a densidade valem as
mesmas considerações feitas para o P.E. Os alcanos são menos densos que a
água, já que as interações entre as moléculas são mais fracas.
Os alcanos são solúveis em
solventes apolares, como benzeno, CCl4, CS2, éter etc.
Respeitando a regra: “semelhante dissolve semelhante” (apolar dissolve
apolar).
Reações
Os alcanos participam de poucas
reações. Estas ocorrem somente em condições rigorosas e normalmente resultam
de misturas de produtos. No final da reação, obtêm-se produtos da
substituição de átomos de hidrogênio do alcano por outros átomos ou
grupos de átomos.
O hidrogênio que sofre mais
facilmente substituição é o ligado ao carbono terciário, e o mais
dificilmente substituível é o ligado ao metano. Temos, portanto, a seguinte
ordem decrescente da facilidade de substituição do hidrogênio.

A ordem de reatividade
apresentada indica a orientação da reação para o alcano.
Com a saída de hidrogênio,
verifica-se a formação de radicais, que são derivados de um alcano. A
estabilidade de um radical está relacionada com o alcano que o originou. Se
a facilidade da retirada de átomos de hidrogênio se coloca pela ordem: terc.
> sec. > prim. > CH4, da mesma maneira, também se deve colocar a
ordem de facilidade de formação dos radicais:
Terc. > Sec. > Prim. > · CH3
Portanto, quanto mais estável for
um radical, mais facilmente ele será formado.
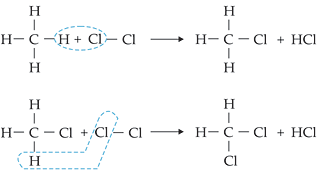
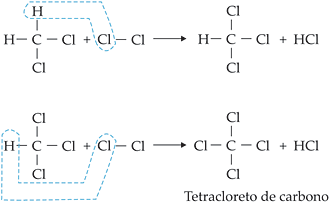
1. Reação de Halogenação
É a reação de substituição que,
neste caso, ocorre entre alcanos e halogênios, principalmente cloro e bromo.
Verificam-se reações com o flúor, desde que este se encontre diluído com um
gás inerte; o iodo não reage.
Na reação de halogênios com
alcanos, forma-se mistura de mono, di, tri ... poli halogênios alcanos. Na
reação com metano e cloro forma-se uma mistura de derivados clorados do
metano. A velocidade das reações de halogenação pode aumentar na presença de
luz solar ou ultravioleta.
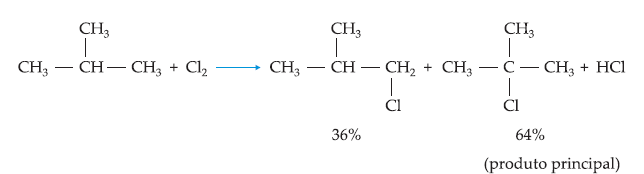
Já
os alcanos com 3 ou mais átomos de carbono sofrem esta reação fornecendo uma
mistura de compostos e ocorrendo em maior quantidade a reação que aconteceu
no carbono mais reativo.
Exemplo

Observação
As
reações de halogenação dos alcanos ocorrem através de uma substituição via
radical livre. O mecanismo pode ser representado da seguinte maneira:
1a
etapa: Cl  Cl
Cl  2Cl
2Cl Cisão homolítica
Cisão homolítica
2a
etapa: H3C
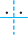 H + Cl
H + Cl

 H3C
H3C + HCl
+ HCl
3a
etapa: H3C + Cl
+ Cl 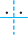 Cl
Cl
 H3C
__ Cl + Cl
H3C
__ Cl + Cl
O
radical livre Cl • formado na 3a etapa reage com o
hidrocarboneto, conforme descrito na 2a etapa.
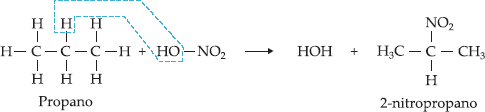
1. Reação de Nitração
Reação de alcanos com ácido
nítrico (HNO3 ou HO – NO2).
Home | Substituição Alcanos | Substituição Aromáticos | Adição Alcenos | Adição Alcinos | Adição Alcadienos | Adição Substituição Ciclanos | Eliminação | Oxidação | Esterificação | Saponificação
Este site foi atualizado em
04/03/19