![]() CINÉTICA
QUÍMICA
CINÉTICA
QUÍMICA![]()

ÍNDICE
| VELOCIDADE DAS REAÇÕES | |
| CONDIÇÕES DE OCORRÊNCIA | |
| FATORES QUE INFLUEM NA VELOCIDADE DA REAÇÃO |
As reações químicas precisam de um certo tempo para se completarem. Algumas reações são extrema-mente rápidas, como, por exemplo, as explosões, enquanto que outras são muito lentas, como é o caso da formação de petróleo. O estudo da velocidade das reações químicas e dos fatores que podem acelerá-la ou retardá-la constitui a chamada cinética química. Este estudo é sem dúvida de grande importância na nossa vida cotidiana, já que muitas reações químicas de interesse industrial podem ser aceleradas, gastando menos tempo para ocorrerem e, portanto, tornando o processo mais econômico.
A velocidade média de consumo de um reagente ou de formação de um produto é calculada em função da variação da quantidade de reagentes e produtos pela variação do tempo.
![]()
O mais comum é representar as quantidades em mol/L e indicá-las entre colchetes; mas elas também podem ser representadas pela massa, quantidade em mols, volume gasoso etc. O intervalo de tempo pode ser representado por: segundos, minutos, horas etc.
Quando é calculada, a variação da quantidade consumida (reagentes), esta será negativa, porque a variação corresponde à quantidade final menos inicial. Para evitar o surgimento de velocidade negativa, usamos o sinal negativo na expressão ou a variação em módulo, sempre que nos referimos aos reagentes.
Exemplo:
N2(g) + 3H2(g)
![]() 2 NH3(g)
2 NH3(g)
vm de consumo de N2 =![]()
vm de consumo de H2 =![]()
vm de formação de NH3 =![]()
Os reagentes são consumidos durante a reação e a sua quantidade diminui com a variação do tempo, enquanto os produtos são formados e suas quantidades aumentam com o tempo. Graficamente, podemos representar.
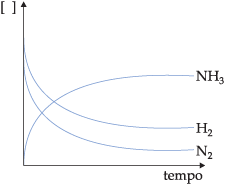
Com relação à velocidade média de consumo ou formação, podemos dizer que diminuem com o passar do tempo, porque a quantidade que reage torna-se cada vez menor.

Para calcularmos a velocidade média de uma reação sem especificar formação ou consumo deste ou daquele produto ou reagente, basta dividirmos a velocidade média de consumo ou formação pelo coeficiente estequiométrico apropriado. Para a reação.
N2(g) + 3 H2(g)
![]() 2 NH3(g)
2 NH3(g)
vm da reação =![]()
Observação – Neste caso, a quantidade que reage ou que é formada não pode ser representada por massa.
Para que uma reação química se processe, devem ser satisfeitas determinadas condições. São elas:
2.1. Afinidade Química
É a tendência intrínseca de cada substância de entrar em reação com uma outra substância. Por exemplo: ácidos têm afinidades por bases, não-metais têm afinidades por metais, reagentes nucleófilos têm afinidade por reagentes eletrófilos.
2.2. Contato entre as Moléculas dos Reagentes
As reações químicas ocorrem como resultado de choques entre as moléculas dos reagentes que se encontram em movimento desordenado e contínuo.
Exemplo
A2 + B2
![]() 2AB
2AB
Para haver reação, o choque entre as moléculas deve provocar rompimento das ligações presentes em A2 e B2, permitindo que novas ligações aconteçam, formando assim a substância AB. Este tipo de choque é denominado por choque efetivo.
O choque será efetivo se houver:
a) direção correta: as moléculas dos reagentes devem colidir numa orientação e num ângulo adequados.
Exemplo 1
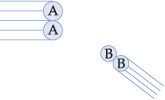
O ângulo e a orientação não favorecem a ocorrência da reação.
Exemplo 2
![]()
O ângulo e a orientação não favorecem a ocorrência da reação.
![]()
Ângulo e orientação são favoráveis à ocorrência da reação.
b) energia de ativação: as moléculas dos reagentes devem colidir com energia suficiente para formar o complexo ativado, que é um composto intermediário e altamente instável, resultante de choques eficientes, em que as ligações iniciais se enfraquecem e as novas ligações começam a se formar. O complexo ativado é o composto mais energético da reação toda.
Exemplo

Chamamos energia de ativação à quantidade de energia que devemos dar aos reagentes para que eles se transformem em complexo ativado. Se representarmos em gráfico os níveis de energia dos reagentes, complexo ativado e produtos em função do caminho da reação, teremos:
Gráfico 1
![]() Reação exotérmica (ΔH < 0)
Reação exotérmica (ΔH < 0)
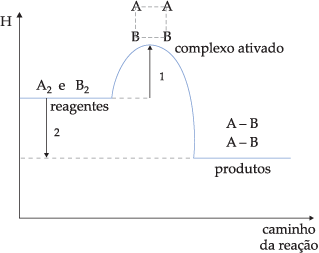
Onde:
1) Energia de ativação
2) Variação de entalpia (ΔH)
Gráfico 2
![]() Reação endotérmica (ΔH > 0)
Reação endotérmica (ΔH > 0)
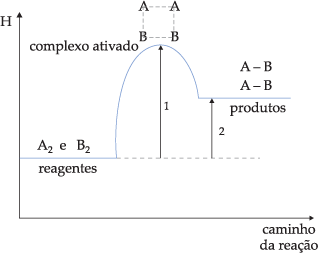
Onde:
1) Energia de ativação
2) Variação de entalpia (ΔH)
Portanto, toda colisão que ocorre e resulta em reação é chamada colisão eficaz ou efetiva, colisão que ocorre e não resulta em reação é chamada de colisão não-eficaz ou não efetiva.
3. Fatores que influem na Velocidade das Reações
Sabemos que a velocidade da reação depende, evidentemente, do número de choques entre moléculas, da violência com que estes choques ocorrem e da orientação correta das moléculas no instante do choque. Entretanto, existem certos fatores externos que influem na velocidade de uma reação. São eles:
3.1. Estado Físico dos Reagentes
De maneira geral, os gases reagem mais rapidamente que os líquidos, e estes mais rapidamente que os sólidos, já que no estado gasoso as moléculas se locomovem com muita facilidade, provocando um grande número de choques, o que facilita a quebra de suas ligações. Já no estado sólido, a superfície de contato, para que ocorra o choque, é pequena, fazendo com que, em geral, a reação seja bastante lenta.
3.2. Temperatura
Todo aumento de temperatura provoca o aumento da energia cinética média das moléculas, fazendo com que aumente o número de moléculas em condições de atingir o estado correspondente ao complexo ativado, aumentando o número de colisões eficazes ou efetivas e, portanto, provocando aumento na velocidade da reação.
Podemos representar graficamente a relação entre o número de moléculas de um sistema em função da cinética destas moléculas (curva de Maxwell-Boltzmann).

Note que, numa temperatura T1, a quantidade de moléculas em condições de reagir (com energia igual ou superior a Eat) é menor que numa temperatura maior T2. O aumento na temperatura faz com que ocorra um aumento da energia cinética média das moléculas, deslocando a curva para a direita, fazendo com que o número de moléculas em condições de reagir aumente.
Uma regra experimental, que relaciona o aumento de temperatura com a velocidade de uma reação é a regra de Van’t Hoff: “Um aumento de 10 °C na temperatura duplica a velocidade de uma reação química”.
Exemplo
Sendo a velocidade de uma reação igual a 3,0 mols/min a 20 °C, calcule a sua velocidade a 50 °C.
Resolução
20 °C __________ 3,0 mols/min
30 °C __________ 6,0 mols/min
40 °C __________ 12 mols/min
50 °C __________ 24 mols/min
3.3. Eletricidade
Existem reações que precisam ser iniciadas por meio de uma descarga elétrica, após o que prosseguem espontaneamente. A faísca elétrica fornece energia para que algumas moléculas possuam condições de reagir (formação do complexo ativado); o calor liberado pela própria reação é suficiente para desencadear a reação na sua totalidade.
Exemplo
2H2(g) +
O2(g)
![]() 2H2O
2H2O
3.4. Luz
Muitas reações adquirem energia da luz, principalmente nas radiações ultravioleta. A luz e outras radiações eletromagnéticas exercem um efeito semelhante ao da eletricidade, fornecendo energia para que, de início, algumas moléculas apresentem condições de reação (energia igual ou superior à energia de ativação).
Exemplo
H2(g) +
Cl2(g)
![]() 2HCl2
2HCl2
3.5. Pressão
A pressão só apresenta influência apreciável na velocidade de reações em que pelo menos um dos reagentes é gasoso. O aumento da pressão causa diminuição de volume acarretando aumento no número de choques, o que favorece a reação e, portanto, aumenta a sua velocidade.
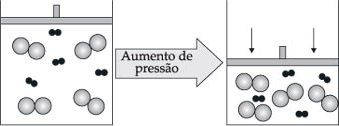
Com a diminuição da pressão, aumenta o volume do recipiente, diminuindo o número de choques moleculares entre os reagentes e, portanto, diminuindo a velocidade da reação.
3.6. Superfície do Reagente Sólido
Quanto maior a superfície do reagente sólido, maior o número de colisões entre as partículas dos reagentes e maior a velocidade da reação.
Em uma reação que ocorre com presença de pelo menos um reagente sólido, quanto mais finamente dividido for este sólido, maior será a superfície de contato entre os reagentes.
Exemplo
Zn(s) +
2 HCl(aq)
![]() ZnCl2(aq) + H2(g)
ZnCl2(aq) + H2(g)
Na equação acima, que representa a reação, se utilizarmos, num primeiro experimento, zinco em barra e, num segundo, zinco em pó, a velocidade da reação no segundo será muito maior que no primeiro experimento.
3.7. Catalisador e Inibidor
Catalisador é a substância que aumenta a velocidade de uma reação, sem sofrer qualquer transformação em sua estrutura. O aumento da velocidade é conhecido como catálise. O catalisador acelera a velocidade, alterando o mecanismo da reação, o que provoca a formação de um complexo ativado de energia mais baixa. São características dos catalisadores:
a) o catalisador não fornece energia à reação;
b) o catalisador participa da reação formando um complexo ativado de menor energia:
c) o catalisador não altera o
![]() H
da reação;
H
da reação;
d) o catalisador pode participar das etapas da reação, mas não é consumido pela mesma.
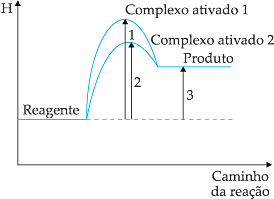

O inibidor é uma substância que diminui a velo-cidade das reações, por formar um complexo ativado de alta energia de ativação. Contudo, o inibidor é consumido pela reação.
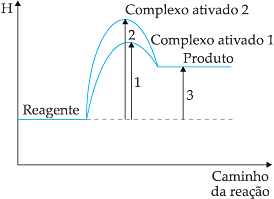

e) as reações envolvendo catalisadores podem ser de 2 tipos:
• catálise homogênea: catalisador e reagentes no mesmo estado físico;
• catálise heterogênea: catalisador e reagentes em estados físicos diferentes.
Exemplos
![]()
Catálise homogênea
![]()
Catálise heterogênea
Observação:
Existem casos de autocatálise, no qual o catalisador é um dos produtos da própria reação. Estas reações iniciam lentamente e à medida que o catalisador vai se formando, a velocidade da reação vai aumentando.
Encontramos substâncias que atuam no catalisador, aumentando sua atividade catalítica: são chamadas de ativadores de catalisador ou promotores. Outras diminuem ou mesmo destroem a ação do catalisa-dor: são chamadas venenos de catalisador.
3.8. Concentração dos Reagentes
Lembrando que uma reação se processa por meio de choques moleculares, conclui-se facilmente que um aumento de concentração dos reagentes determina um aumento da velocidade da reação pois, aumentando-se a concentração, aumenta-se o número de moléculas reagentes e, conseqüen-temente, aumenta, também, o número de choques moleculares..
Vamos analisar a reação entre A e B em 3 situações diferentes, todas ocorrendo num recipiente de mesmo volume:
A + B
![]() AB
AB
1a situação
1 molécula de A e 1 molécula de B

Se houver uma molécula de A e 1 molécula de B, haverá certa probabilidade de choque e, conseqüentemente, certa velocidade de reação.
2a situação
Dobremos a concentração de um dos reagentes:
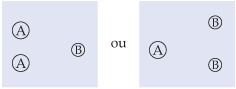
Ao se dobrar a concentração de A (ou de B), a probabilidade de a molécula de um dos reagentes chocar-se com a molécula do outro reagente dobra, e, conseqüentemente, a velocidade da reação aumenta duas vezes.
3a situação
Dobremos a concentração dos dois reagentes.

Se duplicarmos simultaneamente o número de moléculas de A e B, a probabilidade de choque será quatro vezes maior e a velocidade quadruplicará.
Concluindo, podemos dizer que o aumento da concentração dos reagentes (número de moléculas por unidade de volume) aumenta o número de choques, fazendo aumentar a velocidade das reações.
Vários cientistas tentaram estabelecer uma relação matemática entre a velocidade da reação e a concentração, entretanto, foram Guldberg e Waage, em 1867, que enunciaram a lei que relaciona essas duas grandezas, a qual recebeu o nome da Lei da Ação das Massas, cujo enunciado é o seguinte:
“A velocidade de uma reação é diretamente proporcional ao produto das concentrações molares dos reagentes, elevadas a potências determinadas experimentalmente”.
Para reações que se realizam em uma só etapa (reações elementares), as potências que elevam as concentrações coincidem com os coeficientes da reação.
Assim, para a reação:
aA + bB
![]() cC + dD
cC + dD
a lei da velocidade é expressa por:
v = K · [A]a · [B]b
em que:
v
![]() velocidade da reação
velocidade da reação
[A]
![]() concentração molar do reagente A
concentração molar do reagente A
[B]
![]() concentração molar do reagente B
concentração molar do reagente B
a
![]() ordem do reagente A
ordem do reagente A
b
![]() ordem do reagente B
ordem do reagente B
a + b
![]() ordem global da reação
ordem global da reação
K
![]() concentração cinética ou constante de velocidade da reação
concentração cinética ou constante de velocidade da reação
Exemplos
NO2 + CO
![]() NO + CO2
NO + CO2
v = K · [NO] · [CO] Lei de Velocidade
2 NO + H2
![]() N2O + H2O
N2O + H2O
v = K · [NO]2 · [H2] Lei de Velocidade
Para as reações não-elementares (ocorrem em várias etapas), a velocidade da reação é determinada pela velocidade de etapa mais lenta do mecanismo.
Por exemplo:
4 HBr(g) + O2(g)
![]() 2 H2O(g) + 2 Br2(g) (equação global)
2 H2O(g) + 2 Br2(g) (equação global)
cujo mecanismo é:
HBr + O2
![]() HBrO2 (Etapa lenta)
HBrO2 (Etapa lenta)
HBrO2 + HBr
![]() 2 HBrO (Etapa rápida)
2 HBrO (Etapa rápida)
2 HBrO + 2HBr
![]() 2H2O + 2Br2 (Etapa rápida)
2H2O + 2Br2 (Etapa rápida)
A lei de velocidade é determinada pela etapa lenta e não pela equação global.
v = K · [HBr] · [O2]
Em decorrência das considerações feitas acima, podemos definir dois conceitos muito importantes na cinética química:
Ordem: corresponde aos expoentes dos termos de concentração na lei de velocidade.
Exemplo: 2 NO + H2
![]() N2O + H2O
N2O + H2O
v = K · [NO]2 · [H2]
Em relação ao NO, a reação é de 2a ordem ou ordem 2.
Em relação ao H2, a reação é de 1a ordem ou ordem 1.
Em relação à reação, sem especificar reagente, é 3a ordem ou ordem 3 (soma de todos os expoentes na lei de velocidade).
Molecularidade: é o número de moléculas que se chocam para que ocorra uma reação elementar ou uma etapa de uma reação não-elementar. Assim, as reações podem ser moleculares, bimoleculares e trimoleculares.
Exemplo
![]()
3
moléculas que se chocam
![]() reação trimolecular
reação trimolecular
Este site foi atualizado em 04/03/19