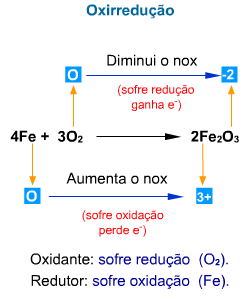
 OXIRREDUÇÃO
OXIRREDUÇÃO

Formação da ferrugem: uma reação de óxido-redução.
1. Introdução
A experiência descrita a seguir mostra o que ocorre quando uma lâmina de zinco é mergulhada em uma solução de sulfato de cobre (CuSO4).
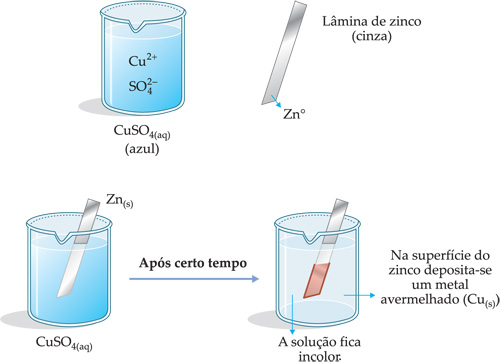
Explicação
Os íons
![]() da solução migram até a barra de zinco Zn(s)
e retiram (ganham) elétrons do metal.
da solução migram até a barra de zinco Zn(s)
e retiram (ganham) elétrons do metal.
Assim, formam-se átomos
neutros de cobre
![]() que se depositam na
lâmina, justificando assim o aparecimento da cor vermelha na superfície do
zinco.
que se depositam na
lâmina, justificando assim o aparecimento da cor vermelha na superfície do
zinco.
Os átomos de zinco (Zn°), ao
perderem seus elétrons, vão para a solução na forma
![]() .
.
Observa-se, assim, que ocorreu
uma reação de transferência de elétrons entre os íons
![]() e os átomos de zinco.
Assim, podemos escrever a seguinte equação:
e os átomos de zinco.
Assim, podemos escrever a seguinte equação:
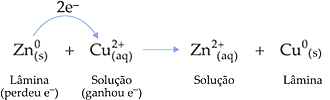
2. Definições
2.1. Oxidação
É a perda de elétrons por uma espécie química.
Exemplo

2.2. Redução
É o ganho de elétrons por uma espécie química.
Exemplo
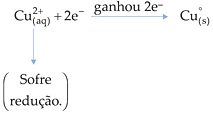

![]()
Formação da ferrugem
Observação macroscópica:

Observação microscópica:
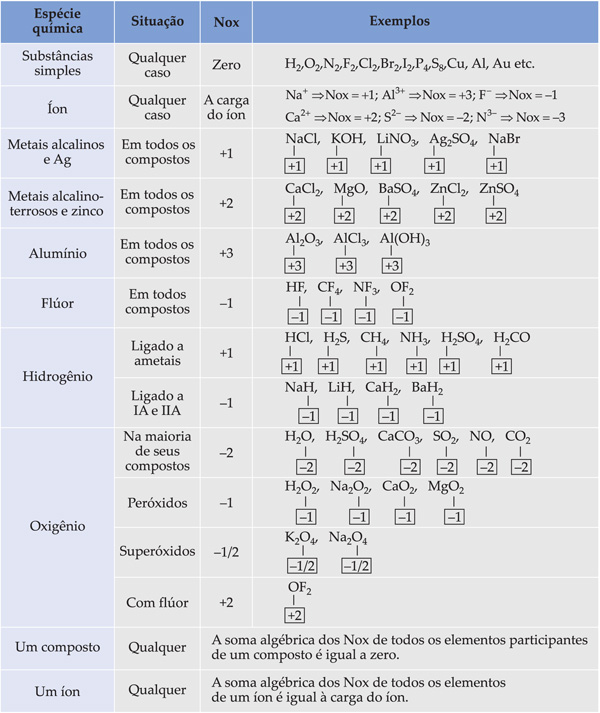
3. Número de Oxidação (Nox)
Nox é o número que designa a carga real (ligação iônica) ou carga aparente (ligação covalente) de um átomo ou de uma espécie química.
3.1. Nox em Compostos Iônicos
É o número que designa a carga real da espécie química.
Exemplos
• Considere o composto formado entre sódio (IA) e cloro (VIIA).
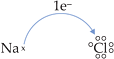
Na° doa 1 e–
e transforma-se em Na+
![]()
Cl° recebe 1 e–
e transforma-se em Cl–

• Considere o composto formado entre magnésio (IIA) e oxigênio (VIA).
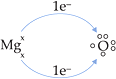
Mg° doa 2 e–
e transforma-se em Mg2+
![]()
O recebe 2 e–
e transforma-se em O2–
![]()
3.2. Nox em Compostos Covalentes
É o número que designa a carga aparente (parcial) do átomo na molécula.
Nox negativo é atribuído ao elemento mais eletronegativo (o que atrai com maior intensidade os e– na ligação covalente).
Nox positivo é atribuído ao elemento menos eletronegativo (o que deixa os elétrons serem atraídos na ligação covalente).
Exemplos
• Fluoreto de Hidrogênio (HF)
Eletronegatividade: F > H
![]()
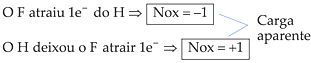
• Água (H2O)
Eletronegatividade: O > H
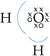
O oxigênio atraiu 2e–,
sendo 1 de cada hidrogênio: 
Cada H deixou o oxigênio atrair 1e–
:
![]()
• Amônia (NH3)
Eletronegatividade: N > H
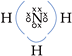
O nitrogênio atraiu 3e–,
sendo 1 de cada hidrogênio:
![]()
Cada H deixou o N atrair 1e–
:
![]()
• Metanal (H2CO)
Eletronegatividade: O > C > H
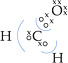
O oxigênio atraiu 2e–
do C:
![]()
Cada H deixou o C atrair 1e–
:![]()

• Gás hidrogênio (H2)
Eletronegatividade: H = H
![]()
O par eletrônico não é atraído por nenhum dos átomos, já que possuem a mesma eletronegatividade.
Com isso, ficamos com:
![]()
3.3. Regras Práticas para Determinação do NOX
4. Oxirredução e Nox

Exemplo
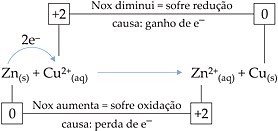
Interpretação
O Zn(s) sofreu oxidação pois teve o seu Nox aumen-tado pelo fato de perder e–.
O
![]() sofreu redução, pois teve o seu Nox diminuído pelo fato de ganhar e–.
sofreu redução, pois teve o seu Nox diminuído pelo fato de ganhar e–.
5. Agente Oxidante e Redutor
5.1. Oxidante
É a espécie reagente que contém o elemento que sofre redução.
Explicação: para que o elemento sofra redução, é necessário causar a oxidação de um outro elemento, daí o nome oxidante.
5.2. Redutor
É a espécie reagente que contém o elemento que sofre oxidação.
Explicação: para que o elemento sofra oxidação, é necessário causar a redução de um outro elemento, daí o nome redutor.
Exemplo
Seja a reação de produção do ferro na siderurgia, a partir da hematita (Fe2O3) e monóxido de carbono (CO).
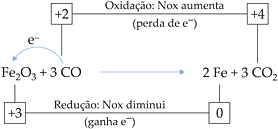
Fe3+ → sofreu redução, logo, Fe2O3 é o agente oxidante (oxidante)
C2+ → sofreu oxidação, logo, CO é o agente redutor (redutor)
6. Balanceamento por Oxirredução
Balancear uma reação de oxirredução é fazer com que o número total de e– cedidos pelo redutor seja igual ao número total de e– recebidos pelo oxidante.
Procedimento
• Determinar o Nox de todos os elementos participantes, antes e depois da reação (reagentes e produtos). Assim é possível identificar o elemento que sofre oxidação e o elemento que sofre redução.
• Calcular a variação total do Nox (D) do elemento que sofre oxidação e do que sofre redução. Para tal, multiplica-se a variação do Nox de cada elemento pela maior atomicidade com que o elemento aparece na equação. Assim saberemos o total de e– perdidos pelo redutor e o total de e– recebidos pelo oxidante (representado pelo D).
• Tomar o D do oxidante como coeficiente do redutor e vice-versa. Isto é feito para que o total de e– perdidos seja igual ao total de e– recebidos.
• Escolha o membro da equação em que os coeficientes (D) serão colocados.
• Ao inverter os coeficientes para colocá-los na equação, estes deverão estar situados ao lado do elemento cujo Nox não se repete na equação. Não importa o membro em que tal elemento se encontre.
• Terminar o balanceamento pelo método das tentativas.
Este site foi atualizado em 04/03/19