 GRANDEZAS
QUÍMICAS
GRANDEZAS
QUÍMICAS
GRANDEZAS - CONCEITOGrandeza pode ser definido com tudo aquilo que pode ser medido, como por exemplo:
tempo → segundos, minutos, horas, dias, etc.
volume → litros, metros cúbicos, mililitros, etc.
massa → gramas, toneladas, quilogramas, etc.
A medida de uma grandeza é feita por comparação com uma grandeza padrão convenientemente escolhida. Desta forma, a medida de massa de um corpo é feita comparando-se a massa de um determinado corpo com a massa de um padrão adequadamente escolhido.
Quando se diz que uma determinada pessoa possui uma massa de 65 kg, podemos interpretar este resultado como da seguinte maneira: a pessoa possui uma massa 65 vezes maior do que o padrão utilizado para medir a sua massa, ou seja, 1 kg.
Dependendo da quantidade de matéria utilizamos uma determinada grandeza para medir a sua massa.
Por exemplo:
| Matéria | Grandeza utilizada para medir a massa |
| comprimido | mg |
| pessoa | Kg |
| automóvel | ton |
E para medir a massa de um átomo ou uma molécula qual será a grandeza utilizada?
UNIDADE DE MASSA ATÔMICA (U)
Átomos individuais são muito pequenos para serem vistos e muito menos pesados. Porém, é possível determinar as massas relativas de átomos diferentes, quer dizer, podemos determinar a massa de um átomo comparando com um átomo de outro elemento utilizado como padrão.
Em 1961, na Conferência da União Internacional de Química Pura e Aplicada (IUPAC), adotou-se como padrão de massas atômicas o isótopo 12 do elemento carbono (12C), ao qual se convencionou atribuir o valor exato de 12 unidades de massa atômica.
Uma unidade de massa atômica (1 u) corresponde
desta forma a
![]() de massa de um átomo de isótopo 12 do carbono.
de massa de um átomo de isótopo 12 do carbono.
Portanto:
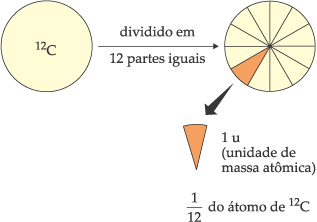
Obs.: O valor de 1 u é de 1,66 · 10–24 g, o que corresponde aproximada-mente à massa de um próton ou de um nêutron.
Massa Atômica (MA)
Massa atômica é o número que indica quantas vezes
a massa de um átomo de um determinado elemento é maior que 1u, ou seja,
![]() do átomo de 12C.
do átomo de 12C.
Comparando-se a massa de um átomo de um determinado elemento com a unidade de massa atômica (1u), obtém-se a massa desse átomo.
Exemplo
Quando dizemos que a massa atômica do átomo de 32S é igual a 32 u, concluímos que:
– a massa atômica de um átomo de 32S é igual a 32 u;
– a massa atômica de um átomo de 32S é
igual a 32 vezes a massa de
![]() do átomo de C-12;
do átomo de C-12;
– a massa de um átomo de 32S é igual a 2,7 vezes a massa de um átomo de C-12.
Observação
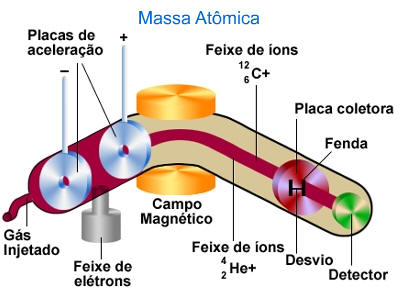
O aparelho utilizado na determinação da massa atômica chama-se espectrômetro de massa. A medida é feita com grande precisão e o processo de determinação da massa do átomo é comparativo com o padrão, ou seja, o átomo de carbono-12.
Massa Atômica de um Elemento
A maioria dos elementos apresenta isótopos. O cloro, por exemplo, é constituído por uma mistura de 2 isótopos de massas atômicas, respectivamente, 35 e 37.
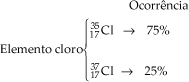
A massa atômica do cloro é dada pela média ponderada das massas isotópicas:
![]()
Portanto:

Sendo assim, a massa atômica de um elemento hipotético A, constituído dos isótopos naturais A1, A2, ...., An, pode ser calculada por:
![]()
Exemplo
Quando dizemos que a massa atômica do elemento cloro é 35,5 u, concluímos que:
– cada átomo do elemento cloro possui massa, em média, de 35,5 u;
– cada átomo do elemento cloro possui massa, em
média, 35,5 vezes maior que
![]() da massa do C-12.
da massa do C-12.
Massa Molecular (MM)
Os átomos reúnem-se para formar moléculas. A massa dessas moléculas é a soma das massas atômicas dos átomos constituintes.
Como as moléculas são formadas por um grupo de átomos ligados entre si, o padrão usado como base para relacionar as massas dessas moléculas é o mesmo usado para os átomos: a unidade de massa atômica (u).
Exemplo:
C6H12O6 (C=12, H=1, O=16)
MM = 6 . 12 + 12 . 1 + 6 . 16
MM = 72 + 12 + 96
MM = 180 u
Significado:
Cada molécula de C6H12O6 possui massa de 180 u, ou seja, 180 vezes maior que 1/12 do carbono-12.
Portanto:

ou ainda...

Vejamos outro exemplo:
Quando dizemos que a massa molecular da água H2O é 18 u, concluímos que:
• a massa de uma molécula H2O é igual a 18 u;
a massa de uma molécula H2O é 18 vezes
mais pesada que
![]() do átomo de carbono-12;
do átomo de carbono-12;
• a massa de uma molécula de água é 1,5 vezes mais pesada que um átomo de C-12.

Constante de Avogadro (N)
Sejam as seguintes amostras: 12 g de carbono, 27 g de alumínio e 40 g de cálcio. Experimentalmente verifica-se que o número de átomos N, existentes em cada uma das amostras, é o mesmo, embora elas possuam massas diferentes. Porém, quantos átomos existem em cada uma dessas amostras? Várias experiências foram realizadas para determinar esse número conhecido como número de Avogadro (N) e o valor encontrado é igual a:
![]()
Assim, o número de Avogadro é o número de átomos em x gramas de qualquer elemento, sendo x a massa atômica do elemento, portanto existem:
• 6,02 · 1023 átomos de C em 12 g de C (MAC = 12 u);
• 6,02 · 1023 átomos de Al em 27 g de Al (MAAl = 27 u);
• 6,02 · 1023 átomos de Ca em 40 g de Ca (MACa = 40 u).
Saiba mais sobre.....
Como foi determinado o Número de Avogadro
Rutherford determinou o número de Avogadro contando as partículas α (alfa) emitidas pelo rádio. Cada partícula α se transforma em um átomo de hélio e elas são emitidas com tanta energia que cada uma produz um sinal visível, numa placa de sulfeto de zinco (ZnS). Isso permite contá-las e, portanto, saber quantos átomos de hélio a amostra de rádio produz em um determinado intervalo de tempo.
Rutherford encontrou que 1 g de rádio produz cerca de 7,7 · 10–6 g de hélio em um ano e calculou que, nesse tempo, 1 g de rádio emitiria 11,6 · 1017 partículas α (e, portanto, 11,6 · 1017 átomos de hélio).
Sendo assim ficamos com:
7,7 . 10-6 g de He → 11,6 . 1017 átomos de He
4 g (He) → N
Onde:
N = 6,02 . 1023 átomos
Conceito de Mol
Segundo a União Internacional da Química Pura e Aplicada (IUPAC), mol é a quantidade de matéria que contém tantas entidades elementares quantos são os átomos de carbono-12 contidos em 0,012 kg do C-12.
Constante de Avogadro é o número de átomos de
C-12 contidos em 0,012 kg de C-12 e seu valor é
6,02 · 1023mol -1.
Portanto:

Sendo que, por exemplo:
• 1 mol de laranjas contém → 6,02 · 1023 laranjas;
• 1 mol de grãos de areia contém → 6,02 · 1023 grãos de areia;
• 1 mol de átomos contém → 6,02 · 1023 átomos;
• 1 mol de moléculas contém → 6,02 · 1023 moléculas;
• 1 mol de íons contém → 6,02 · 1023 íons;
• 1 mol de elétrons contém → 6,02 · 1023 elétrons, etc.
Massa Molar (M)
Massa Molar de um Elemento
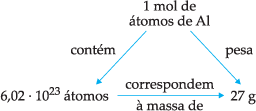
A massa molar de um elemento é a massa em gramas de 1 mol de átomos, ou seja, 6,02 · 1023 átomos desse elemento. A massa molar de um elemento é numericamente igual à sua massa atômica expressa em gramas.
Exemplo:
Al (MA = 27 u)
Massa Molar de uma Substância
A massa molar de uma substância é a massa em gramas de 1 mol de moléculas da referida substância. A massa molar de uma substância é numericamente igual à sua massa molecular expressa em gramas.
Exemplos
a) CO2 (C = 12 u ; O = 16 u)
MM = 1 · 12 + 2 · 16
MM = 12 + 32 = 44 u
Logo, ficamos com:
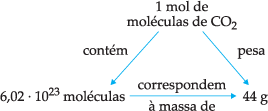
b) NaCl (Na = 23; Cl = 35,5)
MM = 1 · 23 + 1 · 35,5
MM = 23 + 35,5 = 58,5 u
Logo, ficamos com:
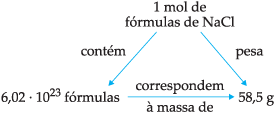
Massa Molar de um Íon
A massa molar de um íon é a massa de 1 mol de íons em gramas que é numericamente igual à massa de íon expressa em gramas.
Exemplo:
![]()
Logo, ficamos com:
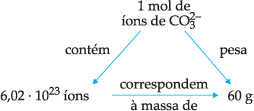
Quantidade de Matéria ou Quantidade em Mols (n)
Exemplo 1
Quantos mols de átomos correspondem a 280 g de ferro? (Fe = 56 u)
Resolução:
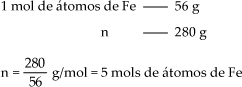
Quantos mols de moléculas correspondem a 88 g de dióxido de carbono (CO2)? (C = 12u, O = 16 u)
Resolução:
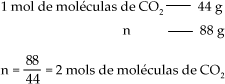
Concluímos, portanto, que estes cálculos podem ser generalizados pela fórmula:
![]()
Onde temos:
• n = quantidade em mols
• m = massa em gramas
• massa molar em gramas/mol
Este site foi atualizado em 04/03/19