 REAÇÕES
QUÍMICAS INORGÂNICAS
REAÇÕES
QUÍMICAS INORGÂNICAS
ÍNDICE

Reações químicas são fenômenos nos quais duas ou mais substâncias reagem entre si, dando origem a outras substâncias diferentes.
A representação gráfica de uma reação química chama-se “equação química”, onde aparecem no primeiro membro os reagentes e, no segundo, os produtos.
Exemplo genérico:
A + B ![]() C + D
C + D
![]()
2.1. Reações de Síntese ou Adição
Quando duas ou mais substâncias reagem, produzindo uma única substância.
Exemplos:
2 H2 + O2
![]() 2 H2O
2 H2O
C + O2
![]() CO2
CO2
SO3 + H2O
![]() H2SO4
H2SO4
A reação de síntese pode ser chamada de síntese total quando os reagentes são todos substâncias simples (1o e 2o exemplos).
Síntese parcial: quando pelo menos um dos reagentes for substância composta (3o exemplo).
2.2. Reações de análise ou decomposição
Quando, a partir de uma substância reagente, produz-se duas ou mais substâncias.
Exemplos:
![]()
![]()
![]()
A reação de decomposição realizada pela ação do calor chama-se pirólise, a realizada pela ação da luz chama-se fotólise e a realizada pela ação da corrente elétrica chama-se eletrólise.
2.3. Reações de Deslocamento ou Simples Troca
Quando uma substância simples reage com uma substância composta, produzindo uma nova substância simples e uma nova composta.
Genericamente temos:
A + BC
![]() AC + B (A deslocou B)
AC + B (A deslocou B)
ou
A + BC
![]() BA + C (A deslocou C)
BA + C (A deslocou C)
Exemplos
Na + AgCl
![]() NaCl + Ag
NaCl + Ag
Zn + 2 HCl
![]() ZnCl2 + H2
ZnCl2 + H2
Cl2 + CaBr2
![]() CaCl2 + Br2
CaCl2 + Br2
Quando duas substâncias compostas reagem, produzindo duas novas substâncias compostas.
Genericamente temos:
![]()
Exemplos
NaCl + AgNO3
![]() AgCl + NaNO3
AgCl + NaNO3
Na2S + 2 HNO3
![]() H2S + 2 NaNO3
H2S + 2 NaNO3
Al(NO3)3 + 3 NaOH
![]() Al(OH)3 + 3 NaNO3
Al(OH)3 + 3 NaNO3
O simples contato entre as substâncias reagentes num sistema não é a condição exclusiva para que uma reação quimica ocorra. Sem dúvida, é necessário que haja contato entre os reagentes, mas deve existir também afinidade química entre eles.
3.1. Reações de Deslocamento ou Simples Troca
As condições de ocorrências das reações de deslocamento ou simples troca são:
Os átomos dos metais possuem raios grandes e elétrons livres na camada de valência; isso faz com que eles tenham grande capacidade de doar elétrons (eletropositividade)
Essa capacidade varia de metal para metal. Por meio de observações experimentais, podemos colocar os principais metais em ordem decrescente de eletropositividade. Esta ordem é chamada fila das tensões eletrolíticas ou fila de reatividade:

Exemplos
1ª Experiência: Zn(s) + CuCl2(aq) →
Observação macroscópica
Interpretação
Ocorre deposição de cobre da solução na superfície da placa de zinco, e a solução que era azul, vai diminuindo a intensidade da coloração, em razão da saída de Cu2+ e passagem de zinco da superfície da placa para a solução, na forma de Zn2+.
Análise microscópica
O Zn perdeu 2 elétrons para o cobre: Zn(s) → Zn2+(aq) + 2e-
O Cu2+ da solução recebeu 2 elétrons do zinco: Cu2+ + 2e- → Cu(s)
Com isso ocorre uma reação química entre o zinco da placa e o cobre da solução:
Zn(s) + CuCl2(aq) → Cu(s) + ZnCl2(aq)
Conclusão: zinco (Zn) deslocou o cobre (Cu2+), com isso podemos concluir que o zinco é mais reativo que o cobre.
2ª Experiência: Cu(s) + ZnSO4(aq) →
Observação macroscópica
Interpretação
Não houve nenhum efeito macroscópico como mudança de cor, liberação de gás ou formação de sólido, indicando que não ocorreu reação química.
Análise microscópica
Como não se observou nenhuma modificação, com isso não ocorreu reação:
Cu(s) + ZnSO4(aq) → Não há reação
Conclusão: cobre (Cu) não deslocou o zinco (Zn2+), com isso podemos concluir que o cobre é menos reativo que o zinco.
Podemos observar, então, que um metal pode doar elétrons para outro metal, desde que seja mais eletropositivo que ele.
Com base na fila de reatividade, podemos prever a ocorrência, ou não, das reações de deslocamento envolvendo metais. Assim, o metal mais eletropositivo (esquerda) deslocará (cederá elétrons) qualquer outro metal menos eletropositivo (direita), caso contrário, a reação será impossível.
Exemplo
Cu + FeSO4
![]() impossível, pois o Cu é menos reativo que o Fe (fila de reatividade)
impossível, pois o Cu é menos reativo que o Fe (fila de reatividade)
Observação– entendemos por nobreza a característica de o metal não apresentar tendência a tomar parte em reações de deslocamento, ou seja, a nobreza é o oposto de reatividade.
Nos casos de reações de metais com ácidos, devemos observar a posição do metal na fila de reatividade, pois os localizados à esquerda do hidrogênio reagem com ácidos, liberando H2 (gás hidrogênio).
Exemplo
Experiência: Zn(s) + HCl(aq) →
Observação Macroscópica
Interpretação
A placa de zinco está sendo consumida na solução de HCl com formação de bolhas (liberação de gás).
Análise microscópica
Reação da placa de zinco ao ser consumida pela solução:
Zn(s) → Zn2+(aq) + 2e-
A liberação das bolhas é devido à formação do gás hidrogênio:
2HCl(aq) + 2e- → 2Cl-(aq) + H2(g)
Com isso temos a seguinte reação:
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
O HNO3 e H2SO4 concentrados, que são muito oxidantes, reagem com metais nobres, mas não liberam o gás hidrogênio (H2) pois, estando após o H na fila de reatividade, não poderão deslocá-lo do ácido. Estas reações são mais complexas.
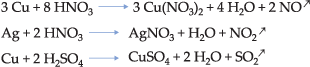
Ocorre também reações de metais com água, nas quais encontramos:
• Os metais alcalinos e alcalino-terrosos reagem violentamente com a água à temperatura ambiente, formando os hidróxidos correspondentes e liberando gás hidrogênio.
Exemplos
![]()
• Os metais comuns reagem com a água por aquecimento, formando os óxidos correspondentes e liberando gás hidrogênio.
![]()
• Os metais nobres não reagem com a água.
Resumindo temos:
II. Deslocamento por Não-Metais
Nos casos de reações de deslocamento com não-metais, verificamos que todos tendem a receber elétrons. Porém, esta capacidade varia de não-metal para não-metal, ou seja, uns têm maior e outros menor tendência em receber elétrons (eletronegatividade).
Por meio de observações experimentais, podemos colocar os não-metais em uma fila de reatividade.
![]()
Com base na fila de reatividade, podemos prever a ocorrência ou não das reações de deslocamentos envolvendo não-metais. Assim, o não-metal mais reativo (esquerda) deslocará (receberá elétrons) qualquer outro não-metal menos reativo (direita), caso contrário, a reação será impossível.
Exemplos
1ª Experiência: NaBr(aq) + Cl2(aq) →
Observação Macroscópica
Interpretação
A solução de cloro inicialmente verde ficou vermelha, indicando que através da mudança de coloração da solução que houve reação química.
Análise microscópica
Ocorreu reação entre Br- e Cl2:
2NaBr(aq) + Cl2(aq) → 2NaCl(aq) + Br2(aq)
Conclusão: o cloro deslocou o bromo, com isso concluímos que o cloro é mais reativo que o bromo.
2ª Experiência: NaCl(aq) + Br2(aq) →
Observação Macroscópica
Interpretação
A solução de bromo inicialmente vermelha ao ser adicionado à solução de NaCl não mudou a coloração, indicando que não houve reação química.
Análise microscópica
Não ocorreu reação entre Cl- e Br2:
NaCl(aq) + Br2(aq) → não há reação
Conclusão: o bromo não deslocou o cloro, com isso concluímos que o bromo é menos reativo que o cloro.
Resumindo temos:
Existem 4 tipos de reações de dupla-troca:
sal1 +
sal2
![]() sal3 + sal4
sal3 + sal4
sal1 + ácido1
![]() sal2
+ ácido2
sal2
+ ácido2
sal1 + base1
![]() sal2
+ base2
sal2
+ base2
ácido + base
![]() sal + água
sal + água
Para verificarmos a ocorrência de uma das reações de dupla-troca citadas, a reação deve-se comportar de modo a atender a uma das seguintes condições.
I. Quando ocorre a formação de um precipitado (produto menos solúvel que os reagentes)
1ª Experiência: NaCl(aq) + AgNO3(aq) →
Análise Macroscópica
Interpretação
Foram misturadas duas soluções incolores e ao término da reação houve formação de precipitado, indicando que ocorreu reação química.
Análise Microscópica
A reação entre NaCl(aq) e AgNO3(aq) ocorreu devido à formação de um sal menos solúvel do que os reagentes, ou seja, formação de um precipitado (AgCl):
NaCl(aq) + AgNO3(aq) → NaNO3(aq) + AgCl(s)
Na+(aq) + Cl-(aq) + Ag+(aq) + NO3-(aq) → Na+(aq) + NO3-(aq) + AgCl(s)
Ag+(aq) + Cl-(aq) → AgCl(s)
Conclusão: Uma das condições que indicam a ocorrência da reação de dupla-troca é a formação de um precipitado.
2ª Experiência: NaCl(aq) + KNO3(aq) →
Análise Microscópica
Interpretação
Foram misturadas duas soluções incolores e no final da mistura não foi verificado qualquer alteração macroscópica.
Análise microscópica
A mistura entre NaCl(aq) e KNO3(aq) não indicou ocorrência de reação química:
NaCl(aq) + KNO3(aq) → NaNO3(aq) + KCl(s)
Na+(aq) + Cl-(aq) + K+(aq) + NO3-(aq) → Na+(aq) + Cl-(aq) + K+(aq) +NO3-(aq)
Conclusão: nenhuma evidência macroscópica indicou a ocorrência da reação.
Vale lembrar que, em geral, as reações químicas ocorrem em solução aquosa.
Observação – Dentre as funções inorgânicas, temos as seguintes regras de solubilidade em água a 25°C:
ácidos: são, em geral, solúveis;
bases: são solúveis as
bases formadas por metais alcalinos e pelo íon amônio
![]() ;
são pouco solúveis as bases formadas por metais alcalino-terrosos e
insolúveis todas as demais;
;
são pouco solúveis as bases formadas por metais alcalino-terrosos e
insolúveis todas as demais;
Sais – a solubilidade dos sais pode ser verificada de acordo com as regras a seguir:
1) Os sais de metais alcalinos e
de amônio
![]() são solúveis.
são solúveis.
2) Os nitratos
![]() e os acetatos (CH3COO– ) são solúveis.
e os acetatos (CH3COO– ) são solúveis.
3) Os cloretos (Cl– ), brometos (Br– ) e iodetos (I– ) são solúveis.
Exceções: Ag+,
![]() e Pb2+
e Pb2+
4) Os sulfatos
![]() são solúveis.
são solúveis.
Exceções: Ca2+, Sr2+, Ba2+ e Pb2+
5) Os sulfetos (S2– ) são insolúveis.
Exceções: alcalinos,
![]() , Ca2+, Sr2+ e Ba2+
, Ca2+, Sr2+ e Ba2+
6) Outros sais: são insolúveis.
Exceções: alcalinos e
![]()
II. Quando ocorre a formação de uma substância volátil
Exemplo: formação de um produto volátil (gás)
Neste exemplo a reação que ocorre é a seguinte:
H2SO4(aq) + Na2CO3(aq) → Na2SO4(aq) + H2O(l) + CO2(g)
Outros exemplos:
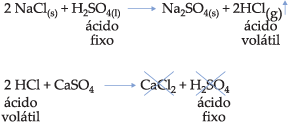
Portanto, essa reação é impossível.
Observação– Dentre as funções inorgânicas, devemos rever a classificação quanto à volatilidade.
Ácidos
– são fixos: H2SO4, H3PO4, H3BO3, H2CrO4, H2C2O4 etc.
– são voláteis: HF, HCl, HBr, HI, H2S, HCN, HNO3, H2CO3, H2SO3 etc.
Ácidos que sofrem decomposição espontânea, por serem instáveis, também são voláteis, de modo que numa equação devemos representar os produtos das decomposições. São eles: H2CO3 e H2SO3.
Bases
A única base volátil é o hidróxido de amônio (NH4OH), que sofre decomposição espontânea. Assim:
Sais
São todos fixos.
III. Quando ocorre a formação de uma substância menos ionizada
Exemplo: com formação de um produto menos ionizado
Neste exemplo a reação que ocorre é a seguinte:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
onde o H2O formado é menos ionizado que o HCl.
Outro exemplo:
Observação– Dentre as
funções químicas, quanto ao grau de ionização ou de dissociação iônica (![]() ),
temos:
),
temos:
Ácidos

Oxiácidos: serão tanto mais fortes quanto maior for a diferença: no de O – no de H ionizáveis.
Se a diferença for zero
![]() ácido fraco. Ex.: H3BO3
ácido fraco. Ex.: H3BO3
Se a diferença for 1
![]() ácido moderado. Ex.: H2SO3
ácido moderado. Ex.: H2SO3
Se a diferença for 2
![]() ácido forte. Ex.: H2SO4
ácido forte. Ex.: H2SO4
Se a diferença for 3
![]() ácido muito forte. Ex.: HClO4
ácido muito forte. Ex.: HClO4
Exceção: H2CO3 é fraco, apesar de a diferença ser igual a 1.
Bases
– são fortes todas as bases
formadas por metais alcalinos e alcalino-terrosos.
![]()
– são fracas todas as demais bases.
Este site foi atualizado em 04/03/19