Termoquímica
-
Reação química e energia
Conceitos
Classificação das
reações termoquímicas
Fatores que
alteram a entalpia dos processos
Princípio da Conservação de Energia ou 1.° Princípio da Termodinâmica
Energia interna (U)
Calor
trocado nos processos sob volume constante
Calor
trocado nos processos sob pressão constante
Calor de reação medido a volume constante e a pressão constante
Lei
de Hess ou da aditividade dos calores de reação
Cálculo
do ∆H de uma reação, usando a lei de Hess
Calor de
combustão ou entalpia de combustão
Com relação ao impacto ambiental, qual o melhor combustível?
Com relação ao poder calorífico, qual o melhor combustível?
Calor de neutralização
Calor de formação
Cálculo do ∆H de uma reação, usando calor de formação
Diagrama de entalpia
Energia de ligação
Cálculo do ΔH de uma reação usando as energias de ligação
A reação espontânea
e não-espontânea
Entropia e organização
Energia de organização
Energia livre de Gibbs (G)
Significado da energia
livre
Resumo

1. Reação química e energia
Termoquímica
é o ramo da termodinâmica que estuda as variações de energia que acompanham
as reações químicas.
Uma reação química indica o rearranjo de elétrons e núcleos de uma
estrutura, para constituir uma nova estrutura. As transformações estruturais
são seguidas de absorção ou escape de energia sob várias formas.
Energia de um sistema é quando o sistema é capaz de executar trabalho. A
energia pode se apresentar de várias formas.
O calor é um exemplo de energia. Uma quantidade de calor é mensurada em
joule, ou em:
- Caloria (cal): é a quantidade de calor fornecida a 1g
de água para elevar sua temperatura em 1°C.
1
cal = 4,185 J
-
Quilocaloria (kcal ou Cal) = 1000 calorias
Calor específico é a quantidade de calor, característica de cada substância,
necessária para que 1g de substância sofra variação de temperatura de 1°C.
O calor específico do ferro é aproximadamente 0,11cal/g.°C, isto é, 1g de
ferro necessita de 0,11cal para elevar sua temperatura de 1°C.
A capacidade térmica de uma substância é equivalente ao calor específico
multiplicado pela massa de substância (m . c).
A capacidade térmica é o quociente entre a quantidade Q de calor recebida ou
cedida por um corpo e a correspondente variação de temperatura.
Lei de Dulong e Petit
“Para muitos elementos sólidos, a capacidade térmica atômica é
aproximadamente 6,4.”
A . c
»
- 6,4
Onde:
A = massa molar do elemento
c = calor específico
2- Conceito
Termoquímica é o ramo da termodinâmica que se preocupa com os calores
das reações (ΔH) e com as trocas de energia entre as reações e o meio onde
ocorrem.
Conceitos importantes
1. Energia Interna (U ou Q) – É a soma de duas outras modalidades de
energia: a energia química e a térmica . U = EQ + ET
a) Energia química – É proveniente das ligações entre os átomos e da
coesão entre as moléculas.
b) Energia térmica – É proveniente dos movimentos de rotação e
translação e da vibração de átomos e moléculas.
2. Entalpia – É o conteúdo energético global de um sistema, ou seja,
a soma da energia química e da energia térmica.
Observação 1 – A única diferença entre energia interna e entalpia é o
meio onde ocorre a reação.
Observação 2 – Sistema adiabático é hermeticamente fechado (vedado),
não permitindo trocas de calor entre o meio interno e o meio externo.
Principais unidades de calor (energia)
a) Caloria (cal);
b) Quilocaloria (kcal);
c) Joule (J);
d) Quilojoule (kJ).
Caloria – Uma caloria é a quantidade de calor fornecida a 1g de água
para elevar sua temperatura em 1°C.
1cal = 4,185J
3-
Classificação das reações termoquímicas
a) Reação endotérmica ou endergônica;
b) Reação exotérmica ou exergônica.
Reação endotérmica – É aquela que se processa com absorção de calor,
ocorre resfriamento do sistema.
Exemplo: cozinhar alimentos.
Representação:
1) A + B + Calor
® AB
2) A + B ®
AB – Calor
3) A + B ®
AB ( ΔH > 0)
Gráfico da cinética da reação endotérmica:
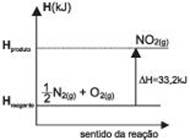
Reação exotérmica – É aquela que se processa com liberação de calor, Hp
< Hr, ΔH < 0 . Aquece o sistema.
Exemplo: combustão e neutralização.
4-
Fatores que alteram a entalpia dos processos
1.° – Quantidade de reagentes e/ou produtos.
2.° – Temperatura e pressão.
Exemplo 1:
1 H2(g) + ½
O2(g)® 1
H2O(l) ΔH1 = - 68,56 kcal/mol (25°C, 1atm)
Exemplo 2:
2 H2(g)
+ 1 O2(g) ® 2
H2O(l) ΔH2 = - 137, 12 kcal/mol (25°C,
1atm)
Observações
a)
O ΔH de uma reação
química sempre faz referência à estequiometria da reação.
b) Geralmente, qualquer variação de pressão altera a velocidade da reação
quando há participantes gasosos.
Porém, para a pressão influir no valor da
entalpia, ela tem que ser superior a 1000atm.
Conclusão
Com
o aumento da temperatura, aumentam-se a energia cinética das moléculas, a
agitação molecular, os movimentos de rotação, translação e vibração de
átomos e moléculas, aumenta-se a energia térmica e, conseqüentemente, a
entalpia do processo.
T = K. Ec
3.° –
Estrutura cristalina ou alotrópica
Alotropia é o fenômeno no qual um mesmo elemento químico dá origem a vários
tipos de substâncias simples diferentes.
Principais elementos que contém alótropos:
a) Carbono: grafite C(gr) (mais estável e menos energético) e diamante C(d).
b) Oxigênio: O2 e O3.
c) Fósforo: vermelho e branco.
d) Enxofre: rômbico e monoclínico.
Sempre o alótropo mais abundante na natureza é o mais estável e o menos
energético.
A diferença de entalpia entre os alótropos está ligada a seu retículo
cristalino. Assim, quanto mais compacto for o retículo cristalino maior será
a energia armazenada por esse retículo e, conseqüentemente, maior será a
entalpia do alótropo.
Exemplo 1:
1 C(gr) + 1 O2(g)
®
1 CO2(g) ΔH1 = – 94 kcal/mol (25°C, 1atm)
Exemplo 2:
1 C(d)
+ 1 O2(g)
®
1 CO2(g) ΔH2 = – 94,5 kcal/mol (25°C, 1atm)
Conclusão
A
segunda reação libera mais energia que a primeira porque a energia
armazenada no retículo cristalino no carbono diamante é maior que a energia
armazenada no carbono grafite. Assim, quanto maior for a energia gasta para
manter o retículo cristalino,
mais compacto ele será; quando este mesmo retículo for “quebrado” no decurso
da reação, maior será a energia liberada no processo.
4.° – O fato de a substância estar ou não em diluição.
a) Entalpia
reticular (Hret)
É a energia fornecida
para separar partículas (íons de um mol de um cristal sólido). Hret>
0
b) Entalpia
de hidratação (Hhid)
É a energia liberada
quando se hidrata 1 mol de íons. Hhid< 0
c) Entalpia
de solução
É a soma da entalpia
reticular e da entalpia de hidratação. Hsol = Hret + Hhid
Observações:
a) Ponto de diluição total ou
infinita –
É o ponto a partir do qual a adição de solvente, ou seja, uma diluição não
mais altera a quantidade de calor absorvida ou liberada pelo processo (H de
solução ou dissolução). Significa que todas as “moléculas” do ácido ou da
base ou do sal que existiam para ionizar ácido ou dissociar bases ou sais
ionizaram-se ou dissociaram-se.
b) A ionização de um ácido ou a dissociação de uma base é
sempre processo exotérmico (Hret < Hhid).
c) A dissociação de um sal pode ser endotérmica (maioria) se Hret
> Hhid ou exotérmica se Hret hid .
5.° –
Estado físico de reagentes e produtos
H2O(sol) « H2O(liq)
« H2O(vap)
Hsol
< Hliq < Hvap

Conclusão
Nesse sentido, pois
aumenta-se a agitação molecular, aumentam-se os movimentos de rotação,
translação e vibração de átomos e moléculas, aumenta-se a energia térmica e,
conseqüentemente, aumenta-se a entalpia do processo. Assim, o simples fato
de mudar de estado é acompanhado de absorção ou liberação de calor.
Observações:
1) Fenômeno químico – É aquele que altera a estrutura íntima
da matéria (reação química).
2) Fenômeno físico – É aquele que não altera a estrutura íntima da
matéria.
Fenômenos físicos endotérmicos – São aqueles que ocorrem com absorção
de calor.
Exemplo: H2O(s)
+ Calor ®
H2O
(l)
Fenômenos físicos
exotérmicos – São aqueles que ocorrem com liberação de energia (calor).
Exemplo: H2O(l)
®
H2O(s) +
Calor
5- Princípio da Conservação de Energia ou 1.° Princípio da Termodinâmica
Numa transformação
(fenômenos físicos ou químicos), se gastarmos x calorias para fazer um
determinado processo, quando o mesmo processo for invertido, x calorias
serão liberadas.
1° – Quantidade de reagentes e produtos
Conclusão – Com o aumento da quantidade de reagentes e produtos, aumenta o
número de ligações, aumenta a energia química e, conseqüentemente, aumenta a
entalpia do processo. Além disso, ao aumentar a quantidade de reagentes,
aumenta o número de colisões, a agitação molecular, a energia térmica e,
conseqüentemente, aumenta a entalpia do processo.
2° -
Reações exotérmicas e
endotérmicas
Quando há liberação de calor, o processo é chamado de exotérmico; e
quando há absorção de calor dizemos que o processo é endotérmico.
Exemplos:
Reação exotérmica
C(grafita)
+ O2(g)
®
CO2(g) + 94,1 kcal
Na reação acima, 1 mol
de CO2(gás) é formado a partir de grafita e oxigênio, ocorrendo a
liberação de 94,1kcal.
Podemos representar as reações exotérmicas através do gráfico abaixo:
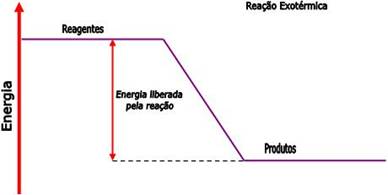
Veja que no gráfico
acima, que os produtos são menores que o conteúdo energético dos reagentes.
Numa reação exotérmica, o calor é escrito assim como um produto.
A + B
®
C + D + x kcal
Reação endotérmica
H2(g) + I2(s)
+ 12,4 kcal
®
2
HI(g)
ou
H2(g) + I2(s)
®
2
HI(g) - 12,4 kcal
Na
reação acima, quando 2 mols de HI (gás) se formaram a partir de hidrogênio e
iodo cristalino foram absorvidas 12,4 kcal.
No processo da reação endotérmica é necessário um fornecimento
externo de energia. Sendo assim, a energia armazenada dos reagentes é menor
que a dos produtos.
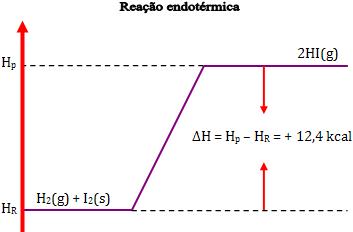
Podemos representar as reações endotérmicas através do seguinte gráfico:
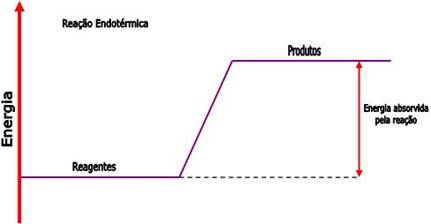
3.
Calor de reação ou energia de reação – uma propriedade extensiva
A “energia de
reação” ou “calor de reação” é a energia térmica liberada ou absorvida numa
reação.
Estando todas as substâncias, desde as iniciais até as finais, com a mesma
temperatura e com a mesma pressão, o calor de reação mede a diferença de
energia entre os reagentes e os produtos.
O calor de reação é considerado como uma propriedade extensiva, pois é
sempre proporcional à quantidade de material participante da reação.
4.
Energia
Todo sistema químico tem capacidade para armazenar energia, que pode ter sua
definição atribuída conforme o mecanismo de armazenagem.
Portanto, temos: Energia Cinética, Energia Potencial Gravitacional, Energia
Potencial Elétrica e Energia Química.
Energia potencial gravitacional: mecanismo: separação de massas (Lei de
Newton).
Energia potencial elétrica: mecanismo: separação de cargas.
Desse modo, é preciso realizar um trabalho para separar as cargas de sinais
opostos.
Energia química:
mecanismo: separação de reagentes
Desse modo, os gases oxigênio e hidrogênio podem reagir quando se misturam,
produzindo água e liberando a energia armazenada.
Energia
cinética – mecanismo: movimento
Os átomos e moléculas que se movimentam possuem energia cinética.
Por exemplo: uma molécula de CO2 apresenta três tipos de
movimento:
Translação: quando o movimento da molécula ocorre de um lugar para o
outro.
Rotação: quando o movimento da molécula ocorre em torno de seu centro
de massa.
Vibração: quando o movimento dos átomos ocorre alternadamente para
perto e para longe do centro de massa.
Formas de
transferência de energia
A transferência de energia para dentro e para fora do sistema é ocasionada
por uma mudança na quantidade de energia armazenada nesse sistema.
Essa energia transferida é definida de acordo com as condições sob as quais
a transferência ocorre:
- Trabalho (energia mecânica) – condição de
transferência: mudança no movimento.
Desse modo, a liberação de energia armazenada ocorre para a realização de um
trabalho.
- calor (energia térmica): condição de
transferência: objetos em contato a diferentes temperaturas.
- Luz (energia radiante): condição de
transferência: objetos separados a diferentes temperaturas.
- Eletricidade: condição de transferência:
sistemas que produzem separação de carga.
5. Entalpia (H)
Entalpia é o conteúdo energético global de um sistema, ou seja, a soma da
energia química e da energia térmica.
É indicada por: H
Quando há uma reação no estado do sistema, a variação de entalpia (∆H) é
determinada por:
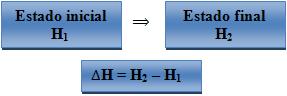
Onde:
H1 – entalpia do sistema no seu estado inicial.
H2 = entalpia do sistema no seu estado final.
Quando a pressão e a temperatura forem as mesmas desde o estado inicial até
o final, o calor da reação será a mediada do ∆H.
Na reação exotérmica, temos H2 menor que H1, de modo
que ∆H tem valor negativo.
Exemplo:
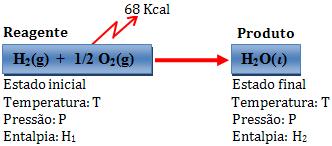
Variação de entalpia:
∆H = H2 – H1 = -68 kcal
Deste modo, um mol de água líquida possui uma energia 68 kcal a não ser que
o sistema formado por 1 mol de H2 e 1/2 mol de O2
gasosos.
Através dos valores imaginários de entalpia, torna-se mais fácil para o
leitor compreender o sinal de ∆H.
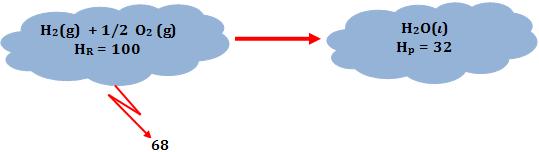
∆H = Hp – HR = 32 – 100 = - 68
Onde:
HR = entalpia dos reagentes
Hp = entalpia dos produtos
A equação pode ser escrita assim:
H2(g) + 1/2 O2(g)
®
H2O(l) ∆H= - 68 kcal
Normalmente, o calor de reação seria um “produto”:
H2(g) + 1/2 O2(g)
®
H2O(l) + 68 kcal
Na reação
endotérmica, temos H2 maior que H1, de maneira
que ∆H tem um valor positivo.
Exemplo:
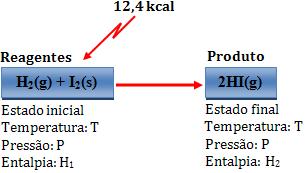
Variação de
entalpia:
∆H = H2 – H1
= 12,4 kcal
Desse modo, dois mols de Hl gasoso possuem energia 12,4 kcal a mais
que o sistema formado por 1 mol de H2 gasoso e 1 mol de I2
sólido.
Através dos valores imaginários, temos:
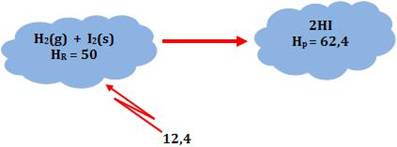
∆H = Hp – HR = 62,4 – 50 = 12,4
A equação pode ser
escrita assim:
H2(g) + I2(s)
®
2
HI(g) ∆H = + 12,4 kcal
Normalmente, o calor
da reação seria um “reagente”.
H2(g) + I2(s) + 12,4 kcal
®
2
HI(g)
ou
H2(g) + I2(s)
®
2
HI(g) - 12,4 kcal
6. Energia interna (U)
Suponha U1 como a energia interna de um sistema. Agora considere
o fornecimento de uma determinada quantidade de calor q ao sistema, que
realizará um trabalho τ sobre o meio ambiente.
A energia interna varia de U1 para U2.
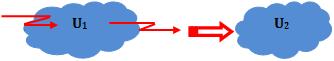
Conforme a primeira
lei da Termodinâmica quando realizamos um trabalho sobre o gás,
comprimindo-o, ou se cedemos calor ao gás, ele recebe energia que conserva
como energia interna.
q =
∆U
+
τ ou
∆U
= q
-
τ
Considerando o
trabalho de expansão de gases, suponha um gás no interior de um cilindro,
que ao expandir-se, o gás empurra um êmbolo contra uma pressão externa (P).
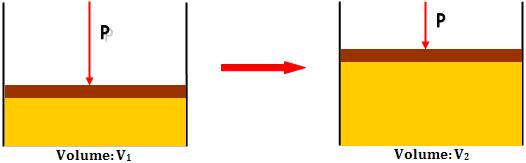
Mostra-se que o
trabalho 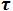 que
o sistema realizou sobre o meio é dado por: que
o sistema realizou sobre o meio é dado por:
τ = P . (V2 - V1) = P .
∆V
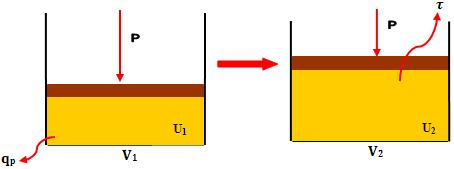
7. Calor
trocado nos processos sob volume constante
Para uma reação que ocorre em recipiente fechado, não há variação do volume,
logo:
∆V = 0 e
τ = P . ∆V = 0
O calor trocado sob
volume constante é representado por pq, o qual resulta-se da primeira lei da
termodinâmica:
∆U = qV -
τ =
qV - 0
→
∆U = qV
Desse modo, quando
medimos o calor liberado na combustão do carbono em um recipiente fechado,
notamos que esse calor é equivalente à variação na energia interna.
8. Calor
trocado nos processos sob pressão constante
A maioria das
reações químicas
ocorre em recipientes abertos. No decorrer desses processos pode ocorrer a
variação no volume do sistema, já a pressão feita pela atmosfera é sempre
constante. Quando a expansão dos gases em recipiente aberto empurra a
atmosfera, realiza-se trabalho P∆V.
Onde, qp é
o calor trocado a pressão constante, logo temos:

Desse modo, podemos
notar que o calor trocado a pressão constante é dado pela diferença entre
dois termos, cada um deles tem a forma:
U
+ P.V
Tal função é chamada
entalpia do sistema, simbolizada por: H
U = U + P.V
Logo, o calor trocado
a pressão constante é dado por:
qp = H2 - H1
= ∆U
onde, ∆H é a variação
de entalpia que ocorre na reação química.
9. Calor de reação medido a volume constante e a pressão constante
Como já sabemos, as reações químicas ocorrem, em sua maioria, em recipientes
abertos, sob a pressão constante da atmosfera. Porém, quando os gases
participam da reação, o calor da reação medido a pressão constante não será
o mesmo do calor medido a volume constante.
Vamos analisar os casos abaixo:
1) Reação com
expansão de volume
Exemplo:
2 C (sólido) + O2(g)
®
2 CO(g)
1 mol 2 mols
- Calor medido a
volume constante
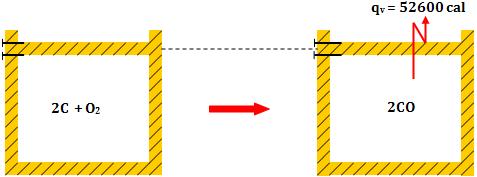
- Calor medido a
pressão constante
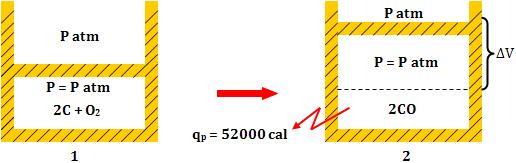
Toda energia sob
volume constante, originada da reação, é liberada na forma de calor (qv).
Sob pressão constante, o sistema é expandido, executando o trabalho 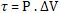 .
Logo, parte daquela energia originada da reação será utilizada na realização
do trabalho .
Logo, parte daquela energia originada da reação será utilizada na realização
do trabalho 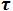 e
o calor liberado (qp) será menor que o calor liberado a volume
constante (qv). e
o calor liberado (qp) será menor que o calor liberado a volume
constante (qv).
2- Reação com
concentração de volume
Exemplo:
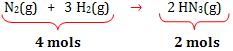
- Calor medido a
volume constante
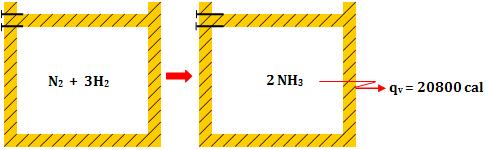
- Calor medido a
pressão constante
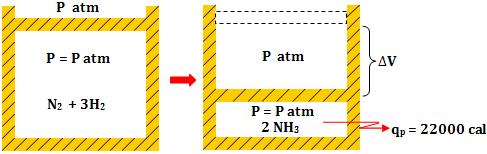
O ar atmosférico, sob
pressão constante, executa um trabalho  contrário
ao sistema, que transfere para o exterior a mesma quantidade de calor.
Portanto, o calor liberado sob pressão constante é maior que o calor
liberado sob volume constante. contrário
ao sistema, que transfere para o exterior a mesma quantidade de calor.
Portanto, o calor liberado sob pressão constante é maior que o calor
liberado sob volume constante.
qp = qV +
τ
3) Não há variação
de volume na reação
 =
∆n . R . T = 0, pois n2 = n1 =
∆n . R . T = 0, pois n2 = n1
Portanto:
qp
= qV
10. Lei de
Hess ou da aditividade dos calores de reação
Quando a reação química ocorre em um ou diversos estágios, a variação de
energia térmica nesse processo é constante, pois a variação de energia
depende apenas das propriedades das substâncias nos estados inicial e final.
A Lei de Hess é bastante utilizada para determinar indiretamente calor de
reação.
O total de calor liberado ou absorvido nas reações sucessivas:
A
®
B
e B
®
C
é equivalente ao calor liberado ou absorvido na reação:
A
®
C
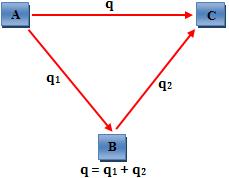
Analogamente, podemos dizer que:
“A variação de entalpia, ou seja, quantidade de calor liberada ou
absorvida por um processo só depende do estado inicial e final do processo
não dependendo das etapas intermediárias.”
A
®
B ®
D
®
C - calor completo – q1
A ®
B ®
C - calor completo – q2
A
®
C - calor completo – q3
q1 = q2 = q3
O
calor liberado ou absorvido na reação A
®
C depende apenas do conteúdo energético de A e C
11. Cálculo do ∆H de uma reação, usando a lei de Hess
Podemos calcular o ∆H de uma reação trabalhando algebricamente as equações
termoquímicas.
Exemplo:
Considere as reações abaixo, a 25°C e 1 atm.
1) C(grafita) + O2(g)
®
CO2(g)
∆H = - 94,1 kcal
2) H2(g) + 1/2 O2(g)
®
H2O
(l) ∆H = - 68,3 kcal
3) CH4(g) + 2 O2(g)
®
CO2(g)
+ 2H2O (ι)
∆H = -
212,8 kcal
Vamos determinar o ∆H da reação:
C(grafita) + 2 H2(g) →
CH4(g) ∆H = ?
Siga os passos abaixo:
a) escreva a equação 1.
b) escreva a equação 2 multiplicada por 2.
c) escreva a equação inversa de 3.
O próximo passo é somá-las.
C(grafita) + O2(g)
®
CO2(g) ∆H =
- 94,1 kcal
2H2(g) + O2(g)
®
2H2O(l)
∆H = - 136,6 kcal
CO2(g) + 2H2O(l)
®
CH4(g) + 2O2(g) ∆H = + 212,8 kcal
C(grafita) + 2H2(g)
®
CH4(g) ∆H = - 17,9 kcal
Através da lei de Hess, as equações termoquímicas podem ser somadas como se
fossem equações matemáticas ou algébricas.
12. Calor de
combustão ou entalpia de combustão
É a variação de entalpia, ou seja, quantidade de calor liberada na combustão
total de 1 mol de determinada substância, a 25°C e 1 atm de pressão.
Exemplos:
C2H6(g) + 7/2 O2(g)
®
2 CO2(g) + 3 H2O(l) ∆H = -372,8 kcal
1H2(g) + 1/2 O2(g) ®
1H2O(l) ∆H = – 68,56kcal/mol
CO(g) + 1/2 O2(g) ®
CO2(g) ∆H = – 67,7 kcal
Queima de glicose
C6H12O6(s) + 6 O2(g)
®
6 CO2(g) + 6 H2O(l) + 15,6 kJ/g de glicose
Combustão de alimentos e combustíveis
Numa combustão de alimento ou combustível há liberação de energia.
Combustão de diamante e de grafita
C(grafita) + O2(g)
®
CO2(g) ∆H = - 94,059 kcal/mol
C(diamante) + O2(g)
®
CO2(g)
∆H = + 94,512 kcal/mol
Em ambas as reações, o oxigênio e o gás carbônico estão nas mesmas
circunstâncias. Desse modo, a diferença nas variações de entalpia na queima
de diamante e grafita está relacionada com a diferença entre as suas
energias.
C(diamante)
→ C(grafita) ∆H = -0,453 kcal/mol
Logo, a energia de 1 mol de grafita é menor que 1 mol de diamante.

13. Com relação ao impacto ambiental, qual o melhor
combustível?
Todo combustível deve apresentar um alto poder calorífico além de produzir
materiais que não poluam o meio ambiente.
A queima de combustível em motores irregulares produz um gás altamente
tóxico, chamado monóxido de carbono (CO).
1 CH4 + 2 O2
® 1
CO2 + 2 H2O
1 CH4 + 1,5 O2 ®
1 CO + 2H2O
A queima dos combustíveis fósseis, como carvão e petróleo, que possuem uma
quantidade de enxofre em sua composição, produz o dióxido de enxofre (SO2)
que é composto tóxico.
S + O2 ®
SO2
O SO2 é transformado em trióxido de enxofre SO3, que
produz o ácido sulfúrico quando entra em contato com a água.
SO2 + 1/2 O2 ®
SO3
SO3 + H2O ®
H2SO4
Através da queima de combustíveis também são produzidos os óxidos de
nitrogênio (NO2, N2O5) que em contato com a
água produzem o ácido nítrico, constituindo, assim, a chuva ácida.
3 NO2 + H2O ®
2 HNO3 + NO
O hidrogênio é considerado o combustível mais adequado para ser usado,
quanto ao impacto ambiental, pois a sua queima só produz água, que não é uma
substância poluente.
14.
Com relação ao poder calorífico, qual o melhor combustível?
Como já vimos no tópico anterior, todo combustível deve apresentar um alto
poder calorífico.
Nesse sentido, o hidrogênio é o combustível mais adequado. A quantidade de
calor liberada durante a combustão de um quilograma de hidrogênio é
aproximadamente três vezes maior do que a quantidade liberada na combustão
de um quilograma de gasolina com 20% de etanol.
15. Calor de neutralização
É a variação de entalpia, ou seja, quantidade de calor liberada verificada
na neutralização total de hidrogênio ionizável (H+) por um mol de hidroxila
dissociada admitindo-se todos os participantes em diluição total ou infinita
(ponto de diluição total), a 25°C e 1atm.
Observações:
– Reação de neutralização é uma reação entre um ácido e uma base produzindo
sal e água.
– Neutralização total é aquela cujo sal formado não apresenta na sua
estrutura hidrogênio ionizável ou hidroxila dissociável.
– Toda vez que a neutralização for proveniente de um ácido forte ou uma base
forte, o ∆H é praticamente constante e vale – 13,7kcal/mol ou – 57,7kJ/mol.
Exemplos:
HBr(aq) + NaOH(aq)
®
NaBr(aq) + H2O(l)
∆H = - 13,76 kcal
HNO3(aq) + NaOH(aq)
®
NaNO3(aq)
+ H2O(l) ∆H = 13,96 kcal
Onde:
aq = solução totalmente diluída.
16. Calor de formação
A entalpia H de um sistema não pode ser calculada experimentalmente, somente
as diferenças ∆H. O calor de formação permitiu calcular a entalpia de várias
sustâncias até então desconhecidas, a partir da variação de entalpia 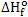 da
própria reação. da
própria reação.
Estado padrão na termoquímica é caracterizado por:
– Temperatura de 25°C
– Pressão de 1atm.
– Estrutura cristalina ou alotrópica mais estável (se for o caso).
– Estado físico usual da substância.
Por convenção, substância simples ou elemento químico no estado padrão
possui entalpia sempre zero.
Calor de formação é a quantidade de calor liberada ou absorvida na
síntese de 1 mol da substância a partir de seus elementos no estado padrão
(forma alotrópica mais estável, a 25°C e 1atm).
Levando em conta a convenção citada acima, podemos concluir que a entalpia H
de uma substância é equivalente ao calor de formação (∆Hf) dessa
substância.
Exemplos:
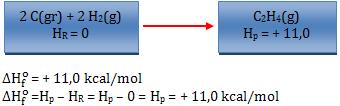
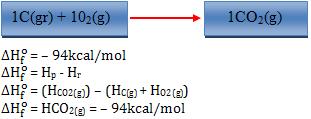
Observação:
- O sobrescrito “o” revela que a variação de entalpia foi medida nas
condições padrão (25°C e 1 atm).

- O sinal (-) indica que o sistema perde.
- O sinal(+) indica que o sistema ganha.
Logo, quando o sinal for (-) significa que a síntese foi exotérmica, quando
o sinal for (+) significa que a síntese foi endotérmica.
17.
Cálculo do ∆H de uma reação, usando calor de formação
Considere a reação do tipo:
A + B
®
C + D ∆H = ?
H1 H2 H3 H4
Tendo conhecimento das entalpias de cada substância através de uma tabela,
podemos calcular o ∆H da reação:
∆H = Hp – HR
∆H = (H3 + H4) – (H1 + H2)
Exemplo:
Considere os calores de formação:
CH4 : ∆Hf = - 17,9 kcal/mol
CO2: ∆Hf = - 94,1 kcal/mol
H2O: ∆Hf = - 68,3 kcal/mol
Vamos calcular a variação de entalpia na seguinte reação:
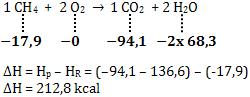
18. Diagrama de entalpia
Segundo a Lei de Hess, a variação de entalpia, ou seja, quantidade de calor
liberada ou absorvida por um processo só depende do estado inicial e final
do processo não dependendo das etapas intermediárias.
Independente do caminho percorrido pelos dois estados, a variação de
entalpia será a mesma.
Seja um sistema no qual o estado inicial será representado por A, e o estado
final por D. Considere que existam dois caminhos, pelos quais podemos obter
o estado final a partir do estado inicial.
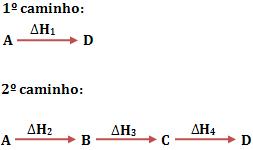
Veja abaixo a representação das entalpias dos vários estados por linhas
horizontais:
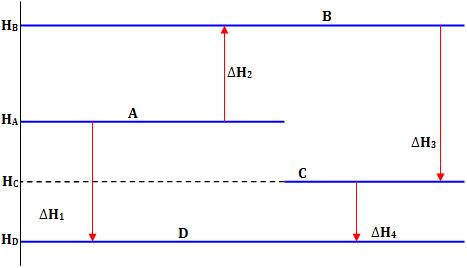
Logo, conforme a Lei
de Hess, devemos ter:
HD – HA = ∆H1 = ∆H2
+ ∆H3 + ∆H4
É por esta razão que a
Lei de Hess é também conhecida como a lei da Atividade das Entalpias.
Dessa forma, é possível representar as variações de entalpia no formato de
diagrama.
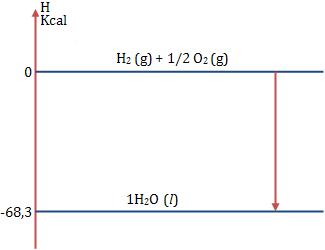
Exemplo:
Vamos representar 1 mol de H2O (l):
19. Energia de ligação
É a variação de entalpia, ou seja, quantidade de calor absorvido na quebra
de 1mol de determinada ligação, admitindo-se todos os participantes no
estado gasoso, a 25°C e 1atm.
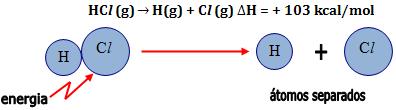
A energia necessária para quebrar 6,02 x 1023 ligações  ,
fornecendo átomos no estado gasoso é 103 kcal. ,
fornecendo átomos no estado gasoso é 103 kcal.
A energia para quebrar
1 mol de ligações O = O, produzindo átomos no estado gasoso, é 118 kcal.
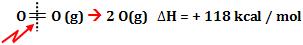
No processo contrário,
ou seja, quando átomos de oxigênio se ligam, formando 6,02 x 1023
ligações, são liberados 118 kcal.
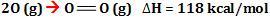
20.
Cálculo de ∆H de uma reação usando energia de ligação
Exemplo
Seja a reação:
H2(g) + 1/2 O2(g) ®
H2O
(g) ∆H = ?
Considere as energias de ligação:

No calculo do ∆H, consideraremos que todas as reações nos reagentes sejam
quebradas, ou seja, a energia é absorvida, e que nos produtos, novas
ligações sejam formadas, ou seja, a energia é liberada.
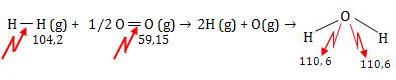

O balanço energético dá o ∆H:
∆H = + 163,35 kcal – 221,2 kcal = - 57,85 kcal
21. A reação espontânea e
não-espontânea
A reação espontânea é aquela que percorre por si mesma.
Toda reação espontânea libera energia livre, enquanto a energia
não-espontânea absorve energia livre.
22. Entropia e organização
A Termodinâmica procurou estabelecer uma função na qual a sua variação
indicasse a espontaneidade de ou não de uma determinada reação. Tal função
foi encontrada de forma empírica e nomeada como entropia.
Consideremos uma reação, sob temperatura constante, na qual Q é o calor
trocado pelo sistema. Nesse processo, a variação de entropia - ∆s é definida
como sendo:
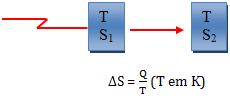
A definição de
entropia é estabelecida de modo que, quanto maior for a falta de organização
de um sistema, maior será a entropia.
O estado gasoso tem maior entropia que o estado líquido, pois o gás
apresenta moléculas movendo-se por todos os lados, provocando uma desordem
no sistema, enquanto o líquido possui uma organização mais regular.
23. Energia de
organização
Sabemos que:

A energia T ∆ S
é denominada energia de organização, ou melhor, variação da energia de
organização, e é destinada a originar uma variação na entropia do sistema.
Observe os dois casos:
a) o sistema
recebe calor

A absorção do calor Q provocará uma desordem no sistema. Nesse caso, o calor
Q é positivo e vale:
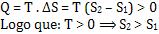
Logo, quanto maior for a energia de organização, ou seja, mais positiva,
maior será a desorganização.
b) o sistema
perde calor

A liberação do calor Q deixa o sistema mais organizado. Aqui, o calor Q é
negativo e vale:
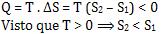
Logo, quanto menor for a energia de organização, ou quanto mais negativa,
mais organizado será o sistema.
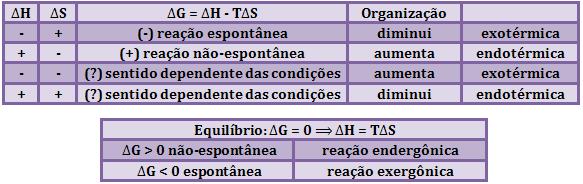
24. Energia livre de Gibbs (G)
Como já vimos anteriormente, um sistema passa por uma reação espontânea
quando a variação total de entropia é positiva.
Vimos também que os sistemas químicos podem variar de um estado de alta
energia para um de baixa energia, esta variação de energia é representada
por ∆H. Os sistemas químicos também podem variar em relação a sua ordem,
passando de um estado de maior ordem para um de menor ordem, esta variação
de ordem é representada por T ∆S. Em razão desses fatos, utilizamos a função
termodinâmica chamada Energia Livre de Gibbs (F ou G).
O ideal é que numa reação química possa ocorrer as duas variações citadas
acima simultaneamente, porém nem sempre isso acontece. Nesse caso, o
equilíbrio entre a variação de energia e a variação de entropia é dado pela
variação de energia livre (∆F ou ∆G).
∆G = ∆H - ∆T. ∆S
Dessa forma,
concluímos que:
1)
Transformação espontânea

2) Transformação não-espontânea

3) Equilíbrio
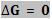
A partir de quando o equilíbrio é obtido, não ocorrerá nenhum estado de mais
baixa energia livre. E desse modo, o ∆G deve ser positivo para uma reação em
qualquer direção.
No estado de equilíbrio, temos:
∆H - ∆T. ∆S = 0
→
∆H = ∆T. ∆S
Portanto, no equilíbrio, a tendência de reduzir a entalpia é igual à
tendência do aumento da entropia.
25. Significado da energia livre
A energia livre de um sistema é a parte da energia que tem capacidade de
realizar trabalho útil.
Qualquer forma de energia liberada por um sistema pode ser completamente
transformada em calor. O calor, por sua vez, pode ser convertido em trabalho
ou em energia potencial, porém tal transformação nunca ocorre por completa,
sempre há a liberação de parte desta energia para o ambiente, e apenas a
outra parte desta energia é convertida em calor.
26. Resumo
Mapa conceitual do Calor

Home | Química Nuclear x Física Nuclear | Ligações Químicas | Atomística | Química Geral | Química Descritiva | Físico Química | Química Orgânica | Evolução Atômica | Teoria Cinética | Cinética Química | Termodinâmica Química | Termoquímica x Termodinâmica | Entropia e Energia Livre | Equação de Nernst | Equação de Van Der Waals | Solução Tampão
Este site foi atualizado em
20/01/24
|