1. (Adaptado
de Atkins) – Ao dobrarmos a concentração de  , a velocidade da reação
, a velocidade da reação  aumenta quatro vezes. Ao dobrarmos as
concentrações de NO e de
aumenta quatro vezes. Ao dobrarmos as
concentrações de NO e de  , a velocidade aumenta 8 vezes. Quais são
(a) a ordem dos reagentes, (b) a ordem total da reação e (c) as unidades de
k, se a velocidade for expressa em mols por litro por segundo?
, a velocidade aumenta 8 vezes. Quais são
(a) a ordem dos reagentes, (b) a ordem total da reação e (c) as unidades de
k, se a velocidade for expressa em mols por litro por segundo?
2. A
reação  é de ordem zero. Sabe-se que, em
determinadas condições, operando em um reator a volume constante, após 1
hora do início da reação, 60% de A reagiu. Que quantidade de B será formada
depois de mais ½ hora de reação?
é de ordem zero. Sabe-se que, em
determinadas condições, operando em um reator a volume constante, após 1
hora do início da reação, 60% de A reagiu. Que quantidade de B será formada
depois de mais ½ hora de reação?
3. A
reação  é de ordem zero e ocorre a volume
constante. Partindo de Z puro a uma pressão de 5 atm, verifica-se que, 20
minutos depois de iniciada a reação, a pressão total do sistema atinge 5,7
atm. Qual será a pressão total do sistema 150 minutos depois de iniciada a
reação?
é de ordem zero e ocorre a volume
constante. Partindo de Z puro a uma pressão de 5 atm, verifica-se que, 20
minutos depois de iniciada a reação, a pressão total do sistema atinge 5,7
atm. Qual será a pressão total do sistema 150 minutos depois de iniciada a
reação?
4. (Adaptado
de Netz) - A hidrólise da sulfacetamida segue cinética de primeira ordem com
constante de velocidade  , a 120° C. Calcular o tempo de meia-vida
e a concentração que resta de sulfacetamida após 3 horas, considerando uma
concentração inicial
, a 120° C. Calcular o tempo de meia-vida
e a concentração que resta de sulfacetamida após 3 horas, considerando uma
concentração inicial  .
.
5. Na
temperatura de 427ºC, a reação de decomposição do pentóxido de nitrogênio em
fase gasosa é de primeira ordem e se processa com uma velocidade de quando a concentração do
quando a concentração do é de
é de (velocidade e concentração iniciais).
(velocidade e concentração iniciais).
Calcule a fração de  decomposta em 10 segundos.
decomposta em 10 segundos.
Calcule o tempo necessário para que 95%
do  se decomponha.
se decomponha.
6. Considere
a reação genérica de primeira ordem  .
São introduzidos em um recipiente 20 mols de A e 4 mols de B. Verifica-se
que após 10 min,
.
São introduzidos em um recipiente 20 mols de A e 4 mols de B. Verifica-se
que após 10 min,  .
Determine a constante de velocidade da reação.
.
Determine a constante de velocidade da reação.
7. Partindo
do mesmo número de átomos de  e
e  , calcule o tempo necessário para que o
número de átomos de In seja igual ao dobro do número de átomos de Bi. A
meia-vida do
, calcule o tempo necessário para que o
número de átomos de In seja igual ao dobro do número de átomos de Bi. A
meia-vida do  é de 24 minutos e a do
é de 24 minutos e a do  é de 33 minutos. Os isótopos decaem para
o
é de 33 minutos. Os isótopos decaem para
o  e o
e o  , respectivamente.
, respectivamente.
8. (Adaptado
de Netz) - Uma determinada reação de decomposição de um fármaco segue
cinética de segunda ordem. Uma concentração inicial de  reduz-se a 80% deste valor em 5 minutos.
Qual a constante de velocidade e qual o tempo de meia-vida?
reduz-se a 80% deste valor em 5 minutos.
Qual a constante de velocidade e qual o tempo de meia-vida?
9. Em
um reator a volume constante ocorre a reação  ,
cuja constante de velocidade em relação a A é de
,
cuja constante de velocidade em relação a A é de  .
Partindo de uma pressão de A igual a 10 atmosferas, e com os gases reagentes
na proporção estequiométrica, calcule a pressão total no sistema depois de
decorridos 5 min.
.
Partindo de uma pressão de A igual a 10 atmosferas, e com os gases reagentes
na proporção estequiométrica, calcule a pressão total no sistema depois de
decorridos 5 min.
10. Uma
substância decompõe-se de acordo com uma lei de velocidade de segunda ordem.
Sendo a constante de velocidade  ,
calcule a meia-vida da substância quando:
,
calcule a meia-vida da substância quando:
a concentração inicial for 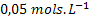
a concentração inicial for 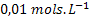
11 . O  emite uma partícula b-, decaindo a
emite uma partícula b-, decaindo a  , o qual, por sua vez, emite outra
partícula b-, formando
, o qual, por sua vez, emite outra
partícula b-, formando  . A meia-vida do primeiro decaimento é
23,5 minutos e a meia-vida do segundo decaimento é 2,35 dias. Partindo-se de
0,1 mol de urânio-239 purificado, determine:
. A meia-vida do primeiro decaimento é
23,5 minutos e a meia-vida do segundo decaimento é 2,35 dias. Partindo-se de
0,1 mol de urânio-239 purificado, determine:
a composição do sistema depois de duas
horas.
o tempo necessário para que a
quantidade de  atinja seu valor máximo.
atinja seu valor máximo.
12. Na
sulfonação do tolueno a 50°C formam-se, principalmente, dois isômeros; o
ácido o-metilbenzenossulfônico e o ácido p-metilbenzenossulfônico. As
reações de sulfonação podem ser consideradas de primeira ordem e a formação
do isômero meta é desprezável. A constante de velocidade de formação do
isômero orto é  .
O rendimento máximo que pode se obter nesse isômero é de 40% em relação à
quantidade inicial de tolueno. Calcule a meia-vida do tolueno naquela
temperatura.
.
O rendimento máximo que pode se obter nesse isômero é de 40% em relação à
quantidade inicial de tolueno. Calcule a meia-vida do tolueno naquela
temperatura.
13. Considere
o seguinte sistema de reações em paralelo, que ocorrem em um reator a volume
constante, e as expressões de suas respectivas constantes de velocidade:


Calcule a relação entre as quantidades de C e D produzidas quando se opera
a 27°C e a 727°, respectivamente.
14. (Adaptado
de Castelan) - Para temperaturas próximas à ambiente, 300K, uma antiga regra
química afirma que um aumento de 10° na temperatura duplica a velocidade da
reação. Admitindo que a constante de velocidade seja duplicada, calcule o
valor da energia de ativação para que esta regra seja verificada
exatamente.
15. (Adaptado
de Castelan) - Para a reação de hidrogênio com iodo, a constante de
velocidade vale  a 302°Ce
a 302°Ce  a 508°C.
a 508°C.
a) Calcule a energia de ativação e o fator de freqüência para esta reação.
b) Qual é o valor da constante de velocidade a 400°C?
16. (Adaptado
de Netz) - Uma determinada substância sofre decomposição segundo uma
cinética de primeira ordem. Os tempos de meia vida determinados a 90°C e
80°C foram 17,4 min e 59,8 min, respectivamente. A partir destes dados,
calcule a energia de ativação e (supondo que esta permaneça constante,
independente da temperatura) estime o tempo de meia-vida a 30 °C.
17. A
reação:
 apresenta uma constante de velocidade
igual a
apresenta uma constante de velocidade
igual a  . Estime, na temperatura de 177°C:
. Estime, na temperatura de 177°C:
A energia de Gibbs padrão de ativação;
A entalpia padrão de ativação;
A entropia padrão de ativação.
18. Supondo
que os diâmetros de colisão molecular A e B sejam, respectivamente  e que sua massas molares sejam 36 e 48
g/mol, calcule o valor do fator estérico para as reações:
e que sua massas molares sejam 36 e 48
g/mol, calcule o valor do fator estérico para as reações:

19. A
racemização do pineno é uma reação de primeira ordem. Em fase gasosa, a
meia-vida calculada foi de  para a temperatura de 457,6 K e de
para a temperatura de 457,6 K e de  min para 510,1K. A partir desses dados,
calcule a energia de ativação e a constante de velocidade a 480 K.
min para 510,1K. A partir desses dados,
calcule a energia de ativação e a constante de velocidade a 480 K.
20. Um
elemento X, quando submetido a nêutrons térmicos transforma-se no elemento
radioativo Y, através de uma reação de ordem zero. Este por sua vez
decai para o elemento estável Z. A meia-vida de Y é de 2 horas. Em um reator
nuclear, a velocidade de formação de Y, a partir de 1 grama de X é de  átomos por hora. Calcule o número de
átomos de Y e Z existentes depois de irradiar-se de 1g de X por 10 horas.
Resposta: Y= 1,03 X 104 ; Z= 2,67 x 104
átomos por hora. Calcule o número de
átomos de Y e Z existentes depois de irradiar-se de 1g de X por 10 horas.
Resposta: Y= 1,03 X 104 ; Z= 2,67 x 104
21. Determinou-se
a constante de velocidade para a decomposição de primeira ordem de um
composto orgânico, em diversas temperaturas:
|
k (s-1)
|
0,00492 |
0,0216 |
0,095 |
0,326 |
1,15 |
|
T (°C) |
5 |
15 |
25 |
35 |
45 |
Calcule a energia de ativação para a
reação.
22. O
avanço de uma reação química em fase aquosa foi monitorado pela determinação
da absorbância do reagente em diferentes tempos, conforme exposto na tabela:
|
Tempo (s)
|
0 |
54 |
171 |
390 |
720 |
1010 |
1190 |
|
Absorbância |
1,67 |
1,51 |
1,24 |
0,847 |
0,478 |
0,301 |
0,216 |
Determine a ordem de reação e o valor
da constante de velocidade.
23. Considere
a reação consecutiva  , na qual ambas as etapas são de primeira
ordem. A concentração inicial de A é
, na qual ambas as etapas são de primeira
ordem. A concentração inicial de A é  e
e  . Faça o gráfico de
. Faça o gráfico de  contra t para
contra t para  = 5,1 e 0,5. Em cada caso determine o
instante em que
= 5,1 e 0,5. Em cada caso determine o
instante em que  atinge o valor máximo. Faça o gráfico de
atinge o valor máximo. Faça o gráfico de  contra t para
contra t para  = 5,1 e 0,5. Em cada caso determine o
instante em que
= 5,1 e 0,5. Em cada caso determine o
instante em que  atinge o valor máximo.
atinge o valor máximo.
24. Resultados
da cinética de inversão da sacarose utilizando medidas do ângulo de rotação
da luz polarizada são mostrados na tabela abaixo. Determine, a partir destes
dados, a ordem da reação. Qual a constante de velocidade desta reação?
|
t(s) |
0 |
1035 |
3113 |
4857 |
9231 |
12834 |
18520 |
26320 |
32640 |
|
|
α(°) |
11,2 |
10,35 |
8,87 |
7,64 |
5,19 |
3,61 |
1,6 |
-0,16 |
-1,10 |
-3,27 |
25.Uma
determinada reação é de ordem ½ em relação ao reagente A, ordem 2 em relação
ao reagente B e ordem zero em relação a C. Qual a influência sobre a
velocidade de reação se:
Triplicarmos a concentração de A?
Triplicarmos a concentração de B?
Triplicarmos a concentração de C?
Reduzirmos a 1/3 a concentração de A?
Reduzirmos a 1/3 a concentração de B?
Reduzirmos a 1/3 a concentração de C?
Triplicarmos as concentrações de A, B e
C simultaneamente?
26. Azometano decompõe-se segundo a equação:
decompõe-se segundo a equação:

Determinar a ordem de reação e a constante de velocidade a partir dos dados
abaixo:
|
Experiência
|
Concentração Inicial
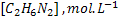 |
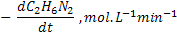
|
|
1 |
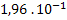
|
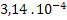
|
|
2 |
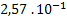
|
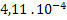
|
27. A
decomposição de primeira ordem do peróxido de hidrogênio  possui uma constante de velocidade de
possui uma constante de velocidade de  a uma certa temperatura. Partindo de uma
concentração inicial de 0,8 mol.L-1 de
a uma certa temperatura. Partindo de uma
concentração inicial de 0,8 mol.L-1 de  , calcule:
, calcule:
A concentração de  após um dia.
após um dia.
O tempo necessário para a concentração
de  cair a 0,75 mol.L-1.
cair a 0,75 mol.L-1.
28. Um
isótopo radioativo se decompõe com uma meia-vida de 15 minutos. Qual será o
tempo necessário para que 80% da amostra se decomponha?
29.Uma
substância gasosa se decompõe termicamente de acordo com a equação:
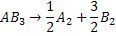
A variação da pressão parcial (que é
proporcional à concentração) do reagente  , a
, a  , em diferentes tempos de reação, está
indicada na tabela abaixo, quando se parte de
, em diferentes tempos de reação, está
indicada na tabela abaixo, quando se parte de  puro:
puro:
|
Tempo (h)
|
0 |
5 |
15 |
35 |
|
Pressão de  (mmHg) (mmHg) |
660 |
330 |
165 |
82,5 |
Considerando que a decomposição é
irreversível, determine a ordem da reação e calcule a constante de
velocidade para essa reação.
30. A
reação  é de primeira ordem em relação a cada
reagente e ocorre em fase gasosa com uma constante de velocidade igual a
é de primeira ordem em relação a cada
reagente e ocorre em fase gasosa com uma constante de velocidade igual a  . O composto B é um sólido volátil cuja
pressão de vapor é de 0,1 atm na temperatura em que a reação ocorre. Calcule
a pressão parcial dos componentes do sistema, 20 min depois de iniciada a
reação, quando a mesma é realizada em um reator a volume constante, em
presença de B sólido, partindo-se de A a uma pressão inicial de 5 atm.
. O composto B é um sólido volátil cuja
pressão de vapor é de 0,1 atm na temperatura em que a reação ocorre. Calcule
a pressão parcial dos componentes do sistema, 20 min depois de iniciada a
reação, quando a mesma é realizada em um reator a volume constante, em
presença de B sólido, partindo-se de A a uma pressão inicial de 5 atm.
31. A
reação  é de 1ª ordem em relação a A e de 2ª
ordem em relação a B. Partindo-se de 10 mols de A e 10 mols de B, e sabendo
que a constante de velocidade da reação, a 25ºC, é
é de 1ª ordem em relação a A e de 2ª
ordem em relação a B. Partindo-se de 10 mols de A e 10 mols de B, e sabendo
que a constante de velocidade da reação, a 25ºC, é  , determine qual a percentagem de A que
reagiu ao final de 4 minutos de reação.
, determine qual a percentagem de A que
reagiu ao final de 4 minutos de reação.
32. A
nitração industrial do nitrobenzeno, realizada a 60ºC, utiliza uma mistura
nitrossulfúrica como agente nitrante e fornece os seguintes produtos:
orto-dinitrobenzeno: 6,40%
meta-dinitrobenzeno: 93,20%
para-dinitrobenzeno: 0,40%
Verificou-se que, partindo de nitrobenzeno puro, após 1 hora do início da
reação, 20% do nitrobenzeno permanecia sem reagir. Calcule as constantes de
velocidade das reações de formação de cada isômero, supondo que as reações
sejam de primeira ordem.
33. Para
o sistema de reações de primeira ordem:

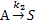
sabe-se que  . Iniciando a reação, a volume constante,
com 50 mols de A, 10 mols de R e 20 mols de S, verifica-se que, após 0,0241
min,
. Iniciando a reação, a volume constante,
com 50 mols de A, 10 mols de R e 20 mols de S, verifica-se que, após 0,0241
min,  . Determine o valor das constantes
. Determine o valor das constantes  e
e  . Resposta
. Resposta
34. Em
um reator isotérmico, a volume constante, ocorrem as reações:
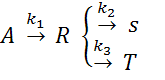
Para a temperatura de 45 oC, as
constantes de velocidade são:


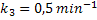
Partindo-se de 50 mols de A, 20 mols de R e 10 mols de T, calcule a
composição do sistema 15 minutos após o início da reação.
35. Os
parâmetros de Arrhenius para a reação
 são
são e
e  . Determine o valor da constante de
velocidade para essa reação, a 25ºC.
. Determine o valor da constante de
velocidade para essa reação, a 25ºC.
36.A
seguinte reação de rearranjo molecular em fase gasosa:
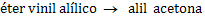
tem uma constante de velocidade de  a 420K e de
a 420K e de  a 470K. Calcule o valor da energia de
ativação dessa reação.
a 470K. Calcule o valor da energia de
ativação dessa reação.
37. As
constantes de velocidade para a reação
 a diferentes temperaturas são:
a diferentes temperaturas são:
|
Temperatura (K)
|
357 |
400 |
458 |
524 |
533 |
615 |
|
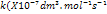
|
1,72 |
2,53 |
3,82 |
5,20 |
5,61 |
7,65 |
Calcule o valor da energia de ativação
dessa reação.
38. A
constante de velocidade para a reação  é fornecida pela expressão
é fornecida pela expressão  . a) Calcule a energia de ativação
experimental a 27°C; b) Calcule a energia de Gibbs padrão de ativação.
. a) Calcule a energia de ativação
experimental a 27°C; b) Calcule a energia de Gibbs padrão de ativação.
39. O seguinte sistema de reações
gasosas ocorre em um reator operando a volume constante:
K1 K2
A ® B e C
® B
As constantes de velocidade são  e
e  . Partindo de 10 mols de A e 8 mols de C,
calcule a composição do sistema quando
. Partindo de 10 mols de A e 8 mols de C,
calcule a composição do sistema quando  .
.
40. Em
um sistema operando a volume constante ocorre a reação gasosa  A reação é de primeira ordem em relação a
cada um dos reagentes e sua constante de velocidade é igual a
A reação é de primeira ordem em relação a
cada um dos reagentes e sua constante de velocidade é igual a  . No reator em questão a pressão de A é
mantida constante e igual a 2 atm mediante alimentação automática. Calcule o
tempo necessário para produzir 1 mol de C partindo de B a uma pressão
inicial de 10 atm. O volume do reator é de 10 litros e o mesmo opera a 27°C.
. No reator em questão a pressão de A é
mantida constante e igual a 2 atm mediante alimentação automática. Calcule o
tempo necessário para produzir 1 mol de C partindo de B a uma pressão
inicial de 10 atm. O volume do reator é de 10 litros e o mesmo opera a 27°C.
Home | Introdução | Leis da Velocidade | Ordens de Reação | Reações Reversíveis | Mecanismos das Reações | Exercícios | Bibliografia
Este site foi atualizado em
04/03/19