Efeito da
temperatura sobre a velocidade das reações químicas
Uma lei de velocidade mostra a relação entre as
velocidades e as concentrações. No entanto, as velocidades também dependem
da temperatura. Com poucas exceções, a velocidade aumenta acentuadamente com
o aumento da temperatura. Van’t Hoff, químico holandês, observou
empiricamente que a cada 10°C de elevação da temperatura, a velocidade da
reação duplica.
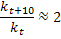
Porém, experimentalmente, observou-se que este
quociente fica, na realidade, entre 2 e 4.
Então, em 1889, o químico sueco Svante Arrhenius (ex-bolsista de Van’n Hoff)
propôs outra equação empírica que proporciona melhores resultados:
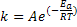
Equação de Arrhenius
Onde:
k= constante de velocidade
Ea= energia de ativação
R= constante dos gases
T= temperatura absoluta
A= fator pré-exponencial
A equação de Arrhenius que pode ser escrita de outras
formas:
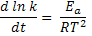
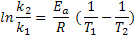
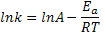
O gráfico abaixo representa a equação de Arrhenius, de
acordo com esta última equação:
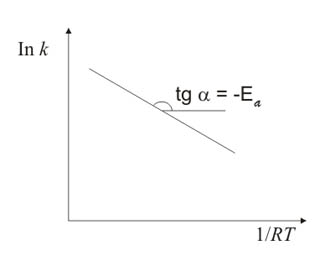
O parâmetro A, dado pela ordenada à origem , em 1/T=0,
é o fator pré-exponencial ou fator de freqüência. O parâmetro A não é
adimensional. Tem as mesmas dimensões da constante de velocidade. Portanto,
suas dimensões variam com a ordem de reação. Embora dependa ligeiramente da
temperatura, este efeito pode ser desprezado para pequenos intervalos de
temperatura. O parâmetro Ea, obtido pela inclinação (-Ea/R) da reta, é a
energia de ativação da reação.
A energia de ativação é a energia cinética mínima que os reagentes devem ter
para que se formem os produtos. Esta é justamente a mais importante
contribuição de Arrhenius: a proposição de que os processos químicos são
ativados, ou seja, precisam de uma certa energia de ativação para ocorrer.
Assim, processos com baixa energia de ativação ocorrem rapidamente, enquanto
processos com elevada energia de ativação ocorrem mais lentamente.
O gráfico a seguir mostra a energia de ativação para um processo exotérmico:
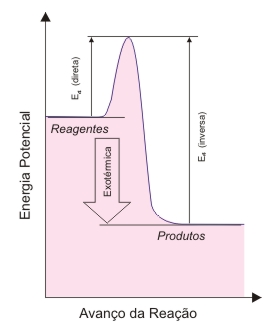
Quanto maior a energia de ativação, menos provável será
a transformação de reagentes em produtos.
A equação de Arrhenius pode ser aplicada para reações gasosas, líquidas e
até reações heterogêneas. O intervalo de temperaturas no qual ela é válida é
amplo para reações elementares, restrito para reações complexas e curto para
reações em cadeia. Ela é mais utilizada para reações monomoleculares. Para
reações bimoleculares costuma-se utilizar a forma modificada da equação de
Arrhenius:
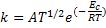
O conceito de energia de ativação de Arrhenius não se
aplica somente a reações químicas. Inúmeros processos físicos também são
ativados e a variação de sua velocidade com a temperatura pode ser descrita
pela equação de Arrhenius. Um exemplo é a difusão de átomos através de uma
rede cristalina no estado sólido.
Explicação do
valor das constantes de velocidade e a dependência de cada uma diante da
temperatura
As leis de velocidade e as constantes de velocidade
permitem o entendimento dos processos moleculares das mudanças químicas. As
leis de velocidade podem ajudar a revelar detalhes dos mecanismos de reação.
Mas como explicar os valores numéricos das constantes de velocidade que
aparecem nas leis de velocidade? A teoria das colisões e a teoria do
complexo ativado fornecem as respostas para esta questão e contribuem para a
explicação de como ocorrem as reações químicas.
Como ocorrem as
reações químicas?
Esta é uma questão crucial em química. Para respondê-la
é necessário examinar, detalhadamente, o que acontece com as moléculas no
ponto decisivo de uma reação. Sabe-se que ocorrem modificações da estrutura
e há redistribuição de energias, da ordem de grandeza das energias de
ligação, entre as diversas ligações. Rompem-se antigas ligações e formam-se
novas.
Hipóteses teóricas a respeito de como se processam as reações em escala
microscópica são essenciais para compreensão e proposição de mecanismos,
para interpretação das velocidades relativas de diferentes reações, para
discussão do peso relativo de reações concorrentes, bem como para
interpretação dos parâmetros das equações empiricamente obtidas. Duas são as
abordagens principais: a teoria das colisões moleculares e a teoria do
complexo ativado.
Teoria das
colisões moleculares
A teoria das colisões moleculares (aplicável aos gases)
faz uso do modelo de esfera rígida para as moléculas. O modelo supõe a não
existência de forças intermoleculares e considera apenas o movimento de
translação. As moléculas são consideradas como esferas rígidas com diâmetro
igual ao diâmetro de colisão molecular, que corresponde à distância mínima
de aproximação de duas moléculas. Para que duas moléculas reajam é
necessário que ocorra uma colisão inelástica entre elas. Somente aquelas
colisões onde a energia relativa das moléculas, devido às componentes da
velocidade tomadas sobre a linha que une centros das moléculas (componentes
frontais), é superior a um determinado valor crítico resultam em reação
química. A teoria simples das colisões moleculares foi desenvolvida por
Lewis e Hinshelwood em 1920, tendo por objetivo o cálculo das constantes de
velocidade.
Aplicando a teoria simples das colisões moleculares a reações bi-moleculares
gasosa:
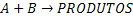
De onde temos a seguinte expressão de velocidade:
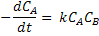
Pode-se escrever a equação anterior da seguinte forma, com as concentrações
sendo expressas em moléculas por unidade de volume:
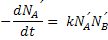
De acordo com a teoria cinética dos gases, a velocidade
da reação é igual à freqüência de colisões bimoleculares com componente
frontal da energia cinética superior a um certo valor crítico, ou seja:
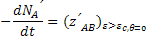
A teoria cinética dos gases nos dá:
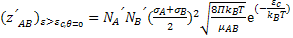
Onde 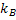 é a constante de Boltzmann.
é a constante de Boltzmann.
Substituindo este valor na equação:
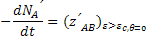
Obtém-se:
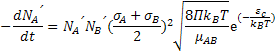
Comparando esta última equação com a equação:
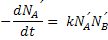
Com
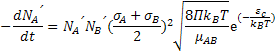
Resulta para a constante de velocidade, k:
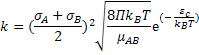
Representando por 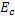 a energia crítica por mol e lembrando que
a energia crítica por mol e lembrando que 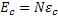 , pode-se escrever a equação anterior
como:
, pode-se escrever a equação anterior
como:
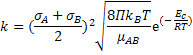
Esta equação é conhecida como equação de Trautz-Mc Lewis e é a base da
teoria das colisões moleculares.
Como visto anteriormente, para as reações bimoleculares costuma-se utilizar
a forma modificada da equação de Arrhenius:
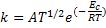
O termo 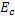 não é exatamente igual a energia de
ativação
não é exatamente igual a energia de
ativação 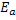 da equação de Arrhenius, o que pode ser
demonstrado utilizando a equação de definição da energia de ativação de
Arrhenius. Logaritmando a equação anterior temos:
da equação de Arrhenius, o que pode ser
demonstrado utilizando a equação de definição da energia de ativação de
Arrhenius. Logaritmando a equação anterior temos:
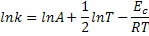
Derivando em relação a T:
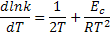
Multiplicando por 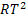 se obtém a energia de ativação de
Arrhenius, também chamada de energia de ativação experimental de Arrhenius:
se obtém a energia de ativação de
Arrhenius, também chamada de energia de ativação experimental de Arrhenius:
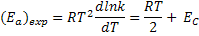
Portanto,
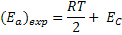
Geralmente, 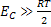 , o que permite desconsiderar
, o que permite desconsiderar 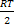 como parcela, fazendo
como parcela, fazendo 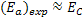 .
.
Comparando agora a equação de Trautz-McLewis:
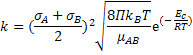
Com a equação de Arrhenius:
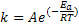
E considerando 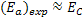 , pelas razões já expostas, podemos ver
que:
, pelas razões já expostas, podemos ver
que:
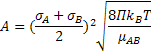
O parâmetro A da equação e Arrhenius é denominado fator de freqüência e está
relacionado à freqüência de colisões entre as moléculas. Para uma dada
reação podemos escrever:
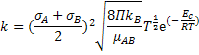
A equação anterior é semelhante à equação de Arrhenius modificada e
justifica o termo em 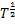 que aparece nessa última.
que aparece nessa última.
A freqüência de colisões impõe um limite para a constante de velocidade, uma
vez que a reação não pode ocorrer com velocidade superior à freqüência com
que as moléculas colidem.
A teoria simples das colisões moleculares obtém seus melhores resultados
quando aplicada às reações bimoleculares. Quanto mais complexas as moléculas
reagentes, piores são os resultados obtidos.
Para dar conta das discrepâncias verificadas entre o valor teórico e o valor
experimental da constante de velocidade, foi proposta a teoria modificada
das colisões moleculares. De acordo com a teoria das colisões modificada a
constante de velocidade de reação pode ser escrita como o produto de um
fator de probabilidade P (também chamado fator estérico) com a freqüência de
colisões Z e a fração de moléculas com energia adequada. O produto PZ pode
ser identificado com o fator pré-exponencial A da equação de Arrhenius.
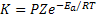
Teoria do Complexo
Ativado
A teoria do complexo ativado aperfeiçoa a teoria das
colisões ao indicar um modo de calcular a constante de velocidade mesmo
quando as exigências estéricas são significativas. A teoria do complexo
ativado, ou teoria do estado de transição, foi desenvolvida por Eyring e
Polanyi (1935). Ela leva em consideração a natureza das moléculas, baseia-se
em cálculos que têm origem na termodinâmica estatística e na mecânica
quântica e pode ser aplicada para reações em fase gasosa e em solução. A
teoria do complexo ativado é uma tentativa de identificar os aspectos
principais que governam o valor de uma constante de velocidade em termos de
um modelo de eventos que ocorrem durante a reação.
Pode-se compreender o conceito de complexo ativado a partir da observação do
aspecto geral da variação da energia potencial dos reagentes A e B durante o
avanço de uma reação elementar bimolecular, como ilustrado no gráfico
abaixo:
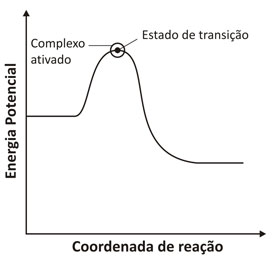
No início, somente A e B entram em contato,
deformam-se, trocam átomos ou rejeitam-nos. A energia potencial atinge um
máximo e a aglomeração de átomos que corresponde à região vizinha ao máximo
é o complexo ativado. Após o máximo, a energia potencial diminui à medida
que os átomos se organizam e atingem a configuração dos produtos. No ponto
máximo da curva de energia potencial as moléculas dos reagentes atingiram um
ponto de aproximação e de deformação tão grande que uma pequena deformação
extra faz o sistema avançar para os produtos. A configuração crítica dos
átomos é o estado de transição da reação. Apesar de algumas moléculas no
estado de transição retornarem à condição inicial dos reagentes, muitas
superam a configuração daquele estado e então é inevitável a formação dos
produtos depois do encontro.
Para esta teoria, numa primeira etapa reversível os reagentes entram em
equilíbrio com um complexo ativado e este então é que se decompõe dando
origem aos produtos da reação.
Como exemplo, segundo esta teoria, uma reação bimolecular, ocorre de acordo
com o mecanismo:
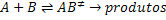
Onde 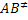 representa o complexo ativado formado
pelas moléculas reagentes. Chamando de
representa o complexo ativado formado
pelas moléculas reagentes. Chamando de 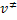 a freqüência de vibração segundo a qual o
complexo ativado se decompõe, a velocidade de formação dos produtos será
dada por:
a freqüência de vibração segundo a qual o
complexo ativado se decompõe, a velocidade de formação dos produtos será
dada por:
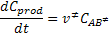
A etapa de formação do complexo ativado tem a seguinte constante de
equilíbrio:
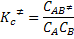
Sendo a concentração do complexo ativado igual a:
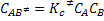
De acordo com o princípio da eqüipartição de energia, a
cada grau de liberdade translacional, vibracional ou rotacional deve ser
associado o valor de energia kT, onde k é a constante de Boltzmann e T a
temperatura e esta energia é igual a 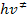 , sendo
, sendo 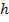 a constante de Planck. Podemos escrever
então:
a constante de Planck. Podemos escrever
então:
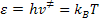
Isolando 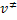 temos a freqüência de decomposição do
complexo ativado:
temos a freqüência de decomposição do
complexo ativado:
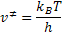
Substituindo os valores de 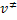 e
e 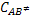 na equação,
na equação,
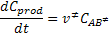
Encontramos:
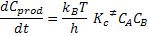
Comparando-se esta equação com a equação cinética que fornece a velocidade
de formação dos produtos,
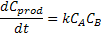
verifica-se que:
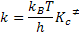
Essa é a equação e Eyring, que é a equação fundamental da teoria do estado
de transição.
Tratamento
termodinâmico da equação de Eyring
Introduzindo algumas grandezas termodinâmicas
(correspondentes à etapa de formação do complexo ativado) a equação de
Eyring pode ser tratada termodinamicamente.
De acordo com a termodinâmica, a energia de Gibbs da reação está relacionada
à constante termodinâmica de equilíbrio pela expressão:
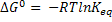
Nessa expressão, o estado padrão é definido como sendo um estado de
atividade unitária. Se ao invés de atividade unitária, definirmos um estado
padrão de concentração unitária, podemos escrever:
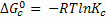
A constante de equilíbrio que aparece na expressão é, agora, a constnate
estequiométrica de equilíbrio. Se esta expressão for aplicad à etapa de
formação do complexo ativado, resulta:
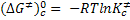
Deixando de lado o sub-índice, c, e colocando a expressão sob a forma
exponencial, obtém-se:
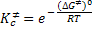
Substituindo 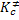 na equação de Eyring, temos:
na equação de Eyring, temos:
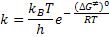
Lembrando, da termodinâmica, que 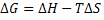 e aplicando esta relação à etapa de
formação do complexo ativado, obtém-se:
e aplicando esta relação à etapa de
formação do complexo ativado, obtém-se:
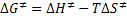
Utilizando este conceito podemos reescrever a equação:
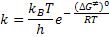
Da seguinte forma:
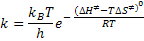
Ou
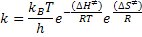
Por outro lado, da relação termodinâmica entre entalpia
e energia interna, podemos escrever:
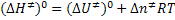
Aqui é importante estabelecer as seguintes grandezas de reação
correspondentes à etapa de formação do complexo ativado:
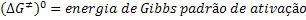
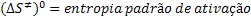
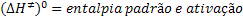
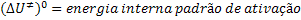
Essas grandezas de reação se referem a um estado padrão de concentração
unitária.
A ligação entre a
teoria de Arrhenius e a teoria do estado de transição
Consideremos a equação já vista acima, na qual a
entalpia padrão de ativação é relacionada à energia interna de ativação:
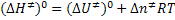
Consideremos também a energia de ativação experimental de Arrhenius dada
por:
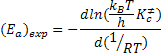
Derivando, primeiro, o numerador da equação anterior, resulta:
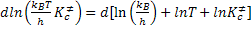
A equação de van’t Hoff permite escrever:
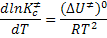
E, sendo 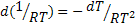 a equação
a equação
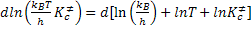
Teremos, derivada termo a termo:
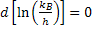 pois kB e h são constantes
pois kB e h são constantes
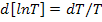 e
e
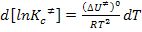
Dará como resultado:
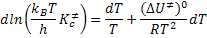
Usa-se o resultado anterior na equação:
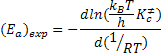
Obtendo-se:
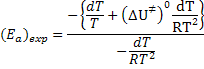
rearranjando e simplificando termos, obtém-se:
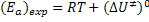
A equação anterior estabelece um elo de ligação entre a teoria de Arrhenius
e a teoria do estado de transição, uma vez que relaciona um parâmetro típico
da primeira, 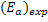 , com a energia padrão de ativação,
, com a energia padrão de ativação, 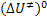 .
.
Home | Introdução | Leis da Velocidade | Ordens de Reação | Reações Reversíveis | Mecanismos das Reações | Exercícios | Bibliografia
Este site foi atualizado em
04/03/19