O que é a
velocidade de uma reação química? Como determiná-la?
Para o estudo da cinética química é
necessário estabelecer uma definição precisa, quantitativa, da velocidade de
uma reação química. No cotidiano, uma reação é dita rápida quando ocorre
quase instantaneamente, como em uma explosão. Já uma reação lenta pode ser
exemplificada com um processo de corrosão de um metal exposto às condições
atmosféricas, que leva um tempo longo para ocorrer.
A velocidade de uma reação química pode ser definida como a variação na
concentração de uma espécie (reagente ou produto) dividida pelo tempo que a
mudança leva para ocorrer.
Um forma de expressar a velocidade de uma reação é através da velocidade
média, calculada a partir da variação da concentração molar de um reagente,
R,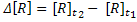 ,durante o intervalo de tempo
,durante o intervalo de tempo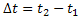 .
.
As velocidades são sempre definidas de
modo a se obter grandezas positivas. Assim, para uma reação R → P define-se:
Velocidade média de consumo: 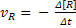
Velocidade média de formação: 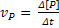
Ou, em termos de variações infinitesimais:
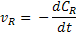
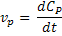
Na cinética química um conceito fundamental é o de velocidade instantânea. A
velocidade instantânea pode ser entendida como uma velocidade média
calculada em um intervalo de tempo muito curto, em torno de um instante de
tempo de referência. Pode-se compreender a velocidade instantânea como o
limite da velocidade média para um intervalo de tempo tendendo a zero, o que
matematicamente corresponde à derivada da função que descreve a variação da
concentração com o tempo.
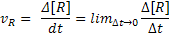
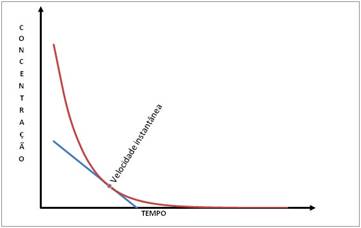
Para obter a velocidade de uma reação em um determinado instante, uma
maneira é traçar a tangente no ponto correspondente do gráfico de
concentração versus tempo. Como se pode ver no gráfico abaixo:
Como se
classificam as reações químicas do ponto de vista cinético?
Do ponto de vista cinético, as reações químicas podem
ser classificadas em elementares e não elementares.
Reações elementares são aquelas que ocorrem em uma só etapa e para elas a
equação estequiométrica traduz perfeitamente o mecanismo pelo qual a reação
ocorre.
Por exemplo, para a reação elementar:
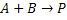
Sua velocidade depende do número de colisões das
moléculas do reagente A com as moléculas do reagente B. Portanto, sua
velocidade será proporcional à concentração do reagente A e à concentração
do reagente B:
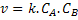
Reações não elementares são aquelas que ocorrem por meio de várias etapas
elementares, cada uma com uma expressão de velocidade própria.
Por exemplo, a reação entre o hidrogênio e o bromo para formar ácido
bromídrico, no estado gasoso:
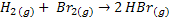
Esta reação foi estudada experimentalmente e verificou-se que ocorre por
meio das seguintes etapas:
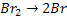 k1
k1
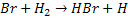 k2
k2
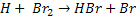 k3
k3
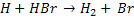 k4
k4
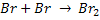 k5
k5
E a velocidade global dessa reação pode ser expressa da
seguinte forma:
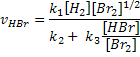
Como pode se observar por este exemplo, a lei de velocidade não pode ser
deduzida da equação química, devendo ser determinada experimentalmente.
O que é a
constante de velocidade?
Na expressão 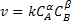 tem-se a constante de proporcionalidade
tem-se a constante de proporcionalidade 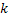 , que é a constante de velocidade da
reação.
, que é a constante de velocidade da
reação.
Matematicamente, k é a velocidade da reação quando as concentrações são
unitárias. A constante de velocidade k tem dimensões que dependem da ordem
de reação:
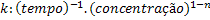
Onde n= ordem da reação.
Como determinar a concentração dos reagentes
e dos produtos, à medida que a reação ocorre?
A determinação das
concentrações dos reagentes e dos produtos em função do tempo de reação é um
procedimento básico da cinética química. Nas experiências comuns de
cinética, a temperatura é mantida constante, pois em geral as velocidades
das reações dependem da temperatura.
Existem diferentes métodos para acompanhar as mudanças de concentração dos
reagentes e dos produtos. A escolha da técnica experimental apropriada
depende da rapidez da reação. Como exemplo pode-se citar as reações que se
processam em femtossegundos (1fs=10-15 s), estudadas pela
femtoquímica. Os principais métodos analíticos usualmente utilizados nas
investigações de cinética química são: