O que é ordem de
reação?
O conceito de ordem de uma reação química está
relacionado à expressão de velocidade. Ordem de reação é a soma dos
expoentes aos quais estão elevadas as concentrações na expressão de
velocidade, e não estão relacionados aos coeficientes estequiométricos.
Para a reação:

Teremos uma lei de velocidade:

Na qual:



E 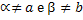
A ordem de reação é determinada experimentalmente, no
caso da cinética empírica, ou por meio de modelos matemáticos, a partir de
dados espectroscópicos e de química teórica sobre as moléculas
participantes, no caso da cinética química teórica. Na prática, as reações
mais importantes são as de ordem zero, primeira e segunda ordens. Reações de
terceira ordem são bastante raras e não são conhecidas reações de ordem
superior a três.
Para conhecer a ordem de reação são necessários dados experimentais e
hipóteses a respeito da seqüência de etapas elementares por meio das quais a
reação ocorre, isto é, do mecanismo da reação.
Uma outra definição importante é a do conceito de molecularidade. A
molecularidade de uma reação é o número de espécies reagentes que tomam
parte em uma etapa elementar da reação. Assim:
- molecularidade 1: apenas uma espécie química participa do processo de
reação. Ex.: um rearranjo molecular.
- molecularidade 2: duas espécies químicas colidem entre si para que a
reação ocorra.
- molecularidade 3: é muito rara, pois depende da ocorrência de uma colisão
tripla.
Enfim, é importante saber a diferença entre molecularidade e ordem:
- A ordem de uma reação é uma grandeza empírica, obtida
a partir da lei de velocidade levantada experimentalmente.
- A molecularidade de uma reação é propriedade de uma reação elementar que
faz parte de um mecanismo teórico de interpretação da reação.
Ordem Zero
Reações de ordem zero
são reações em que a velocidade é uma constante, independente da
concentração do reagente. São sempre reações não-elementares, como por
exemplo, as reações fotoquímicas e as reações enzimáticas no início.
Para uma reação de ordem zero, do tipo A → produtos, pode-se escrever:

Esta equação equivale a  e é por isso que este tipo de reação é
chamado de ordem zero.
e é por isso que este tipo de reação é
chamado de ordem zero.
Verifica-se que a constante de velocidade k para as reações de ordem zero
tem unidades de [concentração] . [tempo-1]. Por exemplo: 
Integrando a equação, considerando-se conhecida a concentração  no tempo t=0:
no tempo t=0:
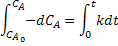
Obtém-se
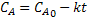
Verifica-se que a
concentração do reagente diminui linearmente com o passar do tempo. Assim, o
gráfico abaixo mostra como deve se comportar a concentração com o passar do
tempo para uma reação de ordem zero.
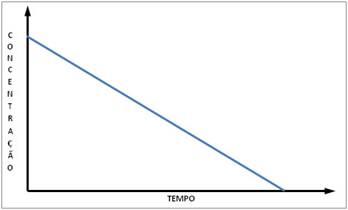
Este mesmo gráfico
permite que se determine experimentalmente a constante de velocidade k da
reação, pois k é o coeficente angular, ou inclinação da reta.
É possível fazer uma troca de variável, introduzindo-se o conceito de taxa
de conversão,  , que é definida como a fração de reagente
já transformada em produtos em um determinado tempo de reação:
, que é definida como a fração de reagente
já transformada em produtos em um determinado tempo de reação:

Isolando-se,  nesta equação, obtém-se:
nesta equação, obtém-se:

E diferenciando-se em relação ao tempo:

Substituindo em  temos:
temos:

E, integrando, vem:



Esta equação permite determinar o tempo necessário para se atingir uma certa
conversão do reagente A.
Um
conceito importante e bastante utilizado em cinética química é o de
MEIA-VIDA. A meia-vida de uma reação é definida como sendo o tempo
necessário para que a concentração do reagente diminua à metade de seu valor
inicial.
A partir da equação acima pode-se obter a meia-vida de uma reação de ordem
zero, pois quando transcorrer uma meia-vida, a concentração será igual à
metade da inicial e, portanto, XA = 0,5, resultando:

e portanto:

Esta equação mostra que a meia-vida de uma reação de ordem zero é
diretamente proporcional à concentração inicial do reagente.
Reações de
Primeira Ordem
Uma reação de primeira ordem é aquela na qual a
velocidade é diretamente proporcional à concentração do reagente.
Para uma reação monomolecular, irreversível, de primeira ordem, ocorrendo a
volume constante, do tipo A→produtos, tem-se:

Trata-se de uma reação de 1ª ordem, pois a concentração do reagente A
encontra-se elevada ao expoente 1.
Nesta equação,  representa a velocidade de decomposição
de A.
representa a velocidade de decomposição
de A.
Verifica-se que a constante de velocidade k para as reações de primeira
ordem tem unidades de [tempo-1].
Separando as variáveis, a equação anterior pode ser integrada entre limites:



A partir desta equação, fazendo-se um gráfico de  em função do tempo, o coeficiente angular
é o termo k, o que permite determinar experimentalmente a constante de
velocidade da reação.
em função do tempo, o coeficiente angular
é o termo k, o que permite determinar experimentalmente a constante de
velocidade da reação.
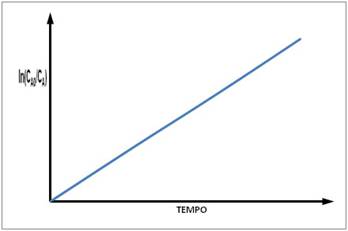
Na forma exponencial a equação acima fica:

Esta equação mostra que a variação da concentração com o tempo para uma
cinética de primeira ordem é exponencial, como representada no gráfico
abaixo:
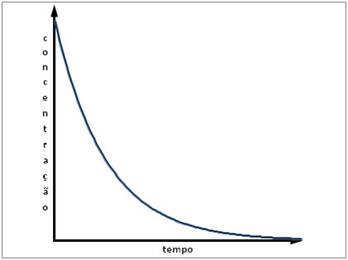
Utilizando-se aqui também o conceito de taxa de
conversão:

É possível isolar  :
:

e

Pode-se então fazer uma troca de variáveis e escrever a equação

em função de  :
:

Que pode ser dividida por  , resultando:
, resultando:

Então, separa-se as variáveis e integra-se, obtendo-se:


Isolando t, se pode obter o valor do tempo necessário para atingir uma
determinada conversão numa reação de primeira ordem:
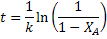
Meia-vida
Meia-vida é um conceito particularmente útil para as
reações de primeira ordem, devido ao fato de estar relacionado diretamente
com a constante de velocidade, dando uma idéia física da velocidade de
reação melhor que a própria constante de velocidade. Lembrando que a
meia-vida de uma reação é o tempo necessário para que a concentração do
reagente se reduza à metade do seu valor inicial e usando para uma reação de
primeira ordem a equação
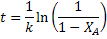
Quando  , tem-se
, tem-se  . Substituindo esse valor na equação
acima, resulta:
. Substituindo esse valor na equação
acima, resulta:

Portanto a meia-vida de uma reação de primeira ordem é dada por:

Como se vê, a meia-vida de uma reação de primeira ordem é independente da
concentração inicial do reagente. Este é o motivo pelo qual a meia-vida é
utilizada, por exemplo, para caracterizar os isótopos radioativos. O
decaimento radioativo é um processo nuclear que segue uma cinética de
primeira ordem. Assim, uma tabela de nuclídeos apresenta os diferentes
isótopos radioativos caracterizados por suas meias-vidas, que serão
independentes das quantidades de núcleos radioativos presentes na amostra.
Reações de Segunda Ordem
Uma reação de segunda ordem é aquela onde há uma
dependência da velocidade com o quadrado da concentração do reagente. Nas
reações de segunda ordem, é preciso ter presente que elas podem ser
monomoleculares ou bimoleculares. Para cada um desses casos, a equação
diferencial resultante será diferente e eles devem ser tratados
separadamente.
Reações de segunda ordem – primeiro caso:
No caso de reação monomolecular:
A→produtos 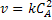
Pode-se escrever então a seguinte equação diferencial:

Verifica-se que a constante de velocidade k para as reações de segunda ordem
tem unidades de [concentração-1].[tempo-1].
Separando as variáveis, a equação anterior pode ser integrada entre limites,
resultando:



Esta é a equação de uma reta, quando se faz um gráfico do inverso da
concentraçãoem função do tempo de reação.
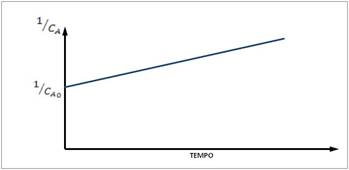
Deste modo, o coeficiente angular da reta obtida é k, o
que permite determinar experimentalmente a constante de velocidade da
reação.
Seguindo o método adotado anteriormente, exemplo, será
introduzida a taxa de conversão  .
.

Isolando-se  :
:

E derivando em relação ao tempo:

Substituindo-se essas expressões em  , tem-se:
, tem-se:

Dividindo membro a membro por  , resulta:
, resulta:

Separa-se então as variáveis desta equação:

Integrando:

E isolando t obtém-se o tempo necessário pra se atingir uma certa conversão
do reagente A:
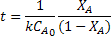
A meia-vida para esse tipo de reação é obtida fazendo  =0,5 na equação anterior:
=0,5 na equação anterior:
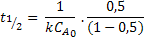

Essa expressão mostra que a meia-vida para uma reação monomolecular de
segunda ordem é inversamente proporcional à concentração inicial do
reagente.
Reações de segunda
ordem – segundo caso:
No segundo caso, para reações bimoleculares de segunda
ordem, pode-se representar a equação estequiométrica da seguinte forma:
aA+bB ®
produtos
Nesse caso é necessário distinguir duas situações
possíveis: a reação pode ser iniciada com a proporção estequiométrica dos
reagentes ou com proporção não estequiométrica. Para cada uma destas
situações a integração da equação diferencial resultante será diferente.
É importante destacar que os reagentes sempre irão reagir em proporção
determinada pela estequiometria. No caso da reação aA+bB→produtos,
independentemente da proporção inicial dos reagentes, sempre que a mols
de A reagirem, b mols de B irão reagir para formar os produtos. Pode-se
então escrever:
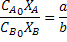
Partindo–se de
proporções estequiométricas dos reagentes:
Para uma reação iniciada com a proporção
estequiométrica dos reagentes, tem-se XA = XB e, portanto:
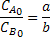
Para a reação aA+bB→produtos, pode-se escrever:

Ou, trocando as variáveis, para usar as taxas de conversão de A e de B:

Dividindo ambos os membros por  , e observando que, para reações iniciadas
com a proporção estequiométrica dos reagentes,
, e observando que, para reações iniciadas
com a proporção estequiométrica dos reagentes,  :
:

Separando-se as variáveis, obtém-se:
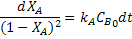
A integração desta equação resulta:

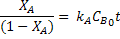
E isolando-se t:
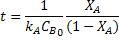
Note-se que, sendo utilizada a constante de velocidade  , aparece na equação a concentração
inicial
, aparece na equação a concentração
inicial  . Por analogia pode-se obter a seguinte
equação:
. Por analogia pode-se obter a seguinte
equação:
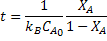
Partindo-se de
proporções não estequiométricas dos reagentes:
Agora será analisado o caso em que a reaçãoaA+bB→produtos inicia
com proporção não estequiométrica dos reagentes. Para essa reação pode-se
escrever:

Considerando que os reagentes são sempre consumidos na proporção
estequiométrica:

e portanto,

Substituindo este valor na equação  , obtém-se:
, obtém-se:

Separando as variáveis e integrando (recomenda-se consultar uma tabela de
integrais), resulta:


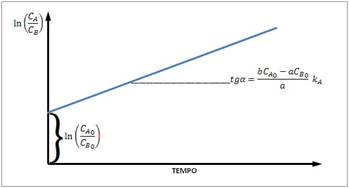
Substituindo os limites de integração e rearranjando chega-se a:

Esta é a equação de uma reta, de modo que fazendo-se um gráfico de ln(CA/CB)
em função do tempo, temos como coeficiente angular o termo  , o que permite determinar
experimentalmente a constante de velocidade da reação, pois as concentrações
iniciais
, o que permite determinar
experimentalmente a constante de velocidade da reação, pois as concentrações
iniciais  e
e são conhecidas, assim como os
coeficientes estequiométricos a e b.
são conhecidas, assim como os
coeficientes estequiométricos a e b.
Home | Introdução | Leis da Velocidade | Ordens de Reação | Reações Reversíveis | Mecanismos das Reações | Exercícios | Bibliografia
Este site foi atualizado em
04/03/19