|
Acima vemos a descrição do clima em Florianópolis no
dia 18 de maio. Dentre os detalhes, figura uma
propriedade interessante: a
umidade relativa do ar, que neste dia era de 78%. O
que significa este número? Há água
na atmosfera? De que maneira, se sabemos muito bem
que a água só entra em ebulição a 100 °C! Nesta
parte de nossa aula sobre o estado gasoso iremos
conhecer uma nova proprieadade: a pressão de vapor.
Aprenderemos que todos os líquidos e muitos sólidos
exibem uma pressão de vapor de equilíbrio que
depende da temperatura.
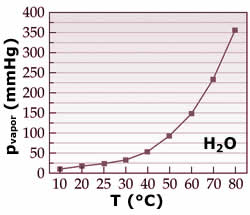
A pressão de vapor aumenta
exponencialmente com o aumento da
temperatura. A ebulição ocorre na
temperatura onde a pressão de vapor se
iguala à pressão externa.
|
Voltemos à questão anterior: o que significa
dizer que há 78% de umidade relativa do ar?
Bem, este número indica a relação entre a quantidade
de água (g) que existe atualmente no ar e a máxima
quantidade possível de água (g) para esta
temperatura. Esta quantidade máxima é fruto da
pressão de vapor da água,
que é uma função de T. A 19°C, a pressão de vapor da
água em equilíbrio com seu líquido é de 16,48 mmHg.
Se a umidade relativa é de
78%, então a pressão real de vapor da água em
Florianópolis no dia 18 de maio era de (0,78 x
16,48) mmHg.
umidade relativa = pvapor(H2O)/p°vapor(H2O)
onde p°vapor(H2O) é a
presão de vapor da água pura nesta temperatura.
Isto dá uma pressão de 12,85 mmHg. Este valor é, na
verdade, a pressão de vapor de equilíbrio da água a
uma temperatura menor: 15°C. Por isso a tabela acima
indica que o "Dew Point", ou
"ponto de orvalho" é de 15°C:
qualquer temperatura abaixo deste valor irá forçar a
uma parcela das moléculas de água dispersas no ar a
se condensar em um líquido - o orvalho.

Se a temperatura baixar o suficiente em um
dia úmido, as moléculas de água podem se
condensar diretamente para a fase sólida,
num processo chamado deposição. Ou geada... |
O que ocorre é que, num líquido ou mesmo em um
sólido, algumas moléculas conseguem escapar da fase
condensada e passar para a fase gasosa. Se o
recipiente for fechado, o número de moléculas que
atingem a fase gasosa chega a um máximo, que aumenta
com o aumento da temperatura. Este máximo
corresponde ao equilíbrio líquido-gás ou sólido-gás
que se estabelece nesta T.
A quantidade de gás no
equilíbrio é dada pela pressão de vapor
que este gás exerce.
Alguns líquidos são mais voláteis do que outros,
ou seja, possuem maior pressão de vapor numa dada
temperatura. Um frasco de éter aberto, por exemplo,
evapora muito mais rapidamente do que o mesmo frasco
com água. Isto porque a pressão de vapor do éter é
muito maior do que a da água na temperatura
ambiente.
A pressão do vapor do éter é tão grande que, logo a
36°C, o éter tem uma pressão de vapor de 1 atm -
igual à da pressão atmosférica ao nível do mar.
Então, o líquido entra em
ebulição, pois produz gás o
suficiente para vencer a pressão externa.
Este fato deve ser levado em conta
quando um gás é coletado sobre uma
interface com um líquido. Um dos
métodos de produção do gás hidrogênio, por exemplo,
envolve a reação do ácido clorídrico (HCl) com um
metal, tal como o zinco (Zn). Devido a existência da
pressão de vapor do líquido (água), o produto final
é uma mistura gasosa, de água e gás hidrogênio.
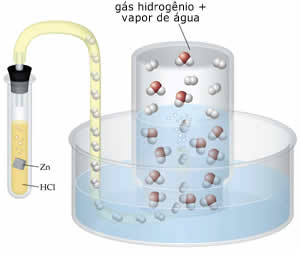
na produção de hidrogênio por este método,
obtêm-se uma mistura gasosa |
Neste caso, pode-se
posteriormente "secar" o gás obtido,
através da remoção da água. Isto pode ser feito pela
passagem do gás por um agente secante, tal como um
sólido higroscópico. Este método de produção de
hidrogênio era largamente empregado nos séculos XVI
a XIX, e era desta forma que o gás era obtido para
os estudos de Boyle, Charles e Gay-Lussac.
A mistura de gás acima pode
ser tratada pelo formalismo de Dalton
(vide etapa anterior de nossa aula). Assim,
podemos usar o sistema acima (desde que conheçamos a
temperatura, a pressão e o volume da fase gasosa
coletada) para determinar a quantidade de metal em
uma determinada amostra. Ainda, a coleta de gases
sobre interface líquida pode ser usada para a
determinação da pressão de vapor do líquido naquela
temperatura, desde que usemos a lei de Dalton.
Na próxima etapa iremos conhecer um modelo teórico
que interpreta muito bem as propriedades dos gases:
o modelo cinético dos gases. Use a barra de
navegação no topo da página para seguir adiante.
|