|

gases.aula#3
a Atmosfera e outras Misturas Gasosas |
|
 Quase
que tudo o que respiramos é o gás nitrogênio:
praticamente 80% da atmosfera é feita por este gás.
Felizmente, os seres vivos se adaptaram a este gás e
ele é totalmente inerte e atóxico ao nosso corpo. Quase
que tudo o que respiramos é o gás nitrogênio:
praticamente 80% da atmosfera é feita por este gás.
Felizmente, os seres vivos se adaptaram a este gás e
ele é totalmente inerte e atóxico ao nosso corpo.
Sob a forma líquida, a cerca de 170 graus celsius
negativo, o nitrogênio é utilizado como um
criogênico. É um líquido em constante ebulição, e o
gás escapa para a atmosfera. A cor branca - vista na
foto ao lado - é na verdade resultante da
condensação do vapor de água presente na atmosfera,
devido o contato com o gás extremamente frio que sai
dos recipientes.
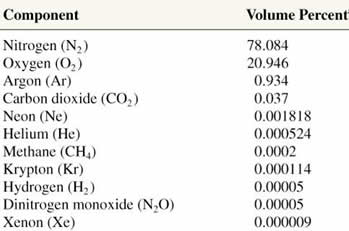
A atmosfera é uma grande mistura gasosa.
A composição desta mistura é, devido a ação do campo
gravitacional terreste,
anisotrópica - isto é, existem
regiões com composições distintas. A baixas
altitudes, na troposfera, os gases mais pesados são
os mais abundantes: nitrogênio, oxigênio, gás
carbônico, argônio e água, entre outros. Na medida
em que se aumenta a altitude, o ar - além de ficar
mais rarefeito - também passa a ser formado de gases
mais leves, como o oxigênio atômico, o hélio, o
hidrogênio, e outros. O
infográfico abaixo indica a
composição média das várias regiões da atmosfera.
A composição da atmofera foi exaustivamente estudada
por John Dalton, em 1800. Seus
estudos, entretanto, serviram para outro propósito:
Dalton compreendeu como se comportavam misturas de
gases, e fez uma observação importante: "cada
gás é um vácuo para o outro gás",
isto é, os gases, numa mistura, se comportam
independentemente, como se estivessem sozinhos
naquele recipiente.
|
Composição
do ar atmosférico
seco ao nível do mar
|
 |
Este fato ficou conhecido como a
Lei de Dalton das misturas de gases.
De acordo com seu postulado,
a pressão total de uma mistura gasosa simplesmente é
a soma das pressões parciais de cada um dos gases.
Então:
p(total) = p(A)
+ p(B) + ... p(N)
Por exemplo: assumindo que o ar
atmosférico tenha 79% de moles de nitrogênio,
20% de moles de oxigênio e 1% de moles de argônio,
temos a seguinte relação em presões:
p(total) = 1,00 atm =
p(N2) + p(O2)
+ p(Ar)
De acordo com Dalton, a
pressão parcial pode ser obtida pela fração molar
(X) do gás na mistura. Então,
p(N2) = X(N2).p(total)
= 0,79 x 1,00 atm = 0,79 atm
Da mesma forma, encontramos que p(O2)
= 0,20 atm e p(Ar)
= 0,01 atm. Isto significa que a pressão
exercida pelo gás oxigênio na atmosfera é de cerca
de 0,2 atm.
A atmosfera contém, também, moléculas de água. Na
próxima etapa iremos aprender mais sobre a pressão
de vapor da água e a umidade relativa do ar. Use a
barra de ferramentas no topo da página para seguir
adiante. |
|
|
 |