|

gases.aula#2
as Leis Empíricas e a Equação de Estado dos
Gases Ideais |
O período entre o século XVII e o final do
século XIX foi de grande importância para a
Química, para a Físico-Química e para a Ciência. Com a
invenção do termômetro (Farheneit) e do
barômetro (Torricelli), aliados a balanças
mais sensíveis, permitiu a um grupo de cientistas,
curiosos e amantes da natureza a descoberta de
propriedades interessantes do estado gasoso; as relações
observadas entre as variações na pressão, na temperatura
e no volume pareciam ser as mesmas para todos os gases.
Estas observações indicavam que os gases eram obedientes
a algumas leis: são as chamadas leis empíricas dos
gases, que juntas culiminam na Equação de Estado
para os Gases Ideais, como veremos a seguir.
|
1) Volume x Pressão: A Lei de
Boyle
|
Olhe atentamente para a figura abaixo. O que aconteceu
com o volume do gás contido no cilindro quando a massa
sobre o pistão foi aumentada? O volume diminuiu. Isto
nos diz que o volume de um gás diminui quando a pressão
sobre este aumenta. E este é o princípio fundamental da
lei de Boyle: o volume de um gás é
inversamente proporcional à sua pressão.

|
Robert Boyle, 1627-1691
|

Boyle foi o primeiro cientista a conduzir
experimentos físico-químicos controlados e a
publicar seus resultados com detalhes
experimentais elaborados, observaçõe criteriosas
e conclusões fundamentadas- tal como nos
papers atuais! |
Em 1662, Robert Boyle publicou um
trabalho chamado "The Spring and Weight of
the Air", algo como "A Mola e o Peso
do Ar". Neste trabalho, Boyle apresenta uma série
de experimentos onde ele media o volume de gases em
função da pressão exercida sobre estes, em diferentes
temperaturas. Seus resultados hoje são conhecidos de
qualquer estudante do ensino médio. Boyle observou que o
volume do gás era inversamente proporcional à pressão
aplicada sobre este. Não obstante, observou que - a uma
mesma temperatura, o produto pressão x volume (pV) é
constante, isto é, uma alteração na pressão provoca tal
alteração no volume de maneira que o produto pV continue
constante.
Então,
pV = constante
A equação acima tem consequências fantásticas. De
partida, nos garante que se soubermos qual é o volume de
um gás a uma certa temperatura e pressão, podemos
predizer qual será o volume a uma pressão maior ou
menor. Como é ilustrado no quadro abaixo, a lei de Boyle
explica vários fenômenos cotidianos envolvendo o produto
pV. A respiração, a sucção, entre outros, são possíveis
graças a esta forte interdependência de p e V para os
gases.
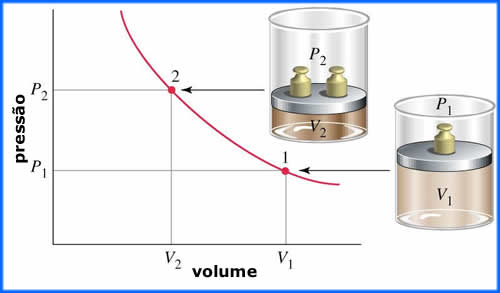
A Figura acima ilustra um
experimento onde o volume de um gás foi
medido isotermicamente (a temperatura constante) em
função da pressão. O conjunto de todos os
pontos experimentais (apenas dois estão ilustrados) dá
uma curva que indica um decréscimo exponencial da
pressão com o aumento do volume. Veremos, adiante, qual
é a expressão para esta curva. Por hora, basta sabermos
que esta curva é conhecida como
isoterma de Boyle para o gás ideal.
|
Lei de Boyle na Respiração:
|
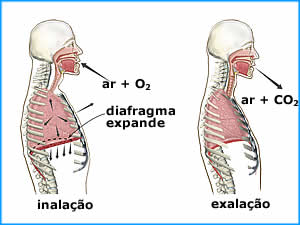
Na respiração, a lei de Boyle pode ser
observada. Na etapa da inalação, o diafragma se
expande deixando o volume do pulmão maior. Como
o produto pV deve ser constante, a pressão
interna do pulmão diminui com este aumento de
volume. Como a pressão atmosférica é maior, ar
entra no pulmão até equalizar as pressões. O
processo inverso ocorre na exalação.
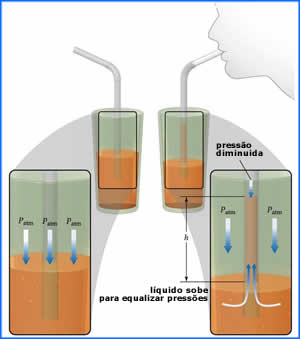
Na sucção, usamos o diafragma para aumentar o
volume do pulmão e diminuir sua pressão interna.
Só que, agora, usamos esta diferença de pressão
com a pressão externa para sugar alguma coisa,
tal como o refrigerante com um canudo.
|
A isoterma de Boyle também indica que o
produto pV é mantido constante em toda a faixa de p e V
apresentado. Por exemplo, é possível ver graficamente
que a área p1V1 é igual à área p2V2, isto é, p1V1=p2V2.
Outro fato importante é sobre a densidade:
a lei de Boyle prevê que a densidade de
um gás seja diretamente proporcional à pressão
exercida sobre este, pois quando a pressão aumenta, o
volume diminui e a densidade (razão entre massa e
volume) fica maior. Por isso o ar é mais rarefeito em
lugares com maior altitude: a pressão atmosférica é
menor (veremos adiante por quê), consequentemente a
densidade é também menor.
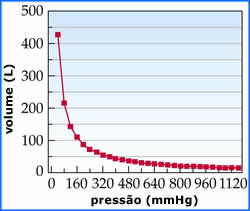
A isoterma acima ilustra outra
observação de Boyle: o volume de
um gás tende ao infinito quando a pressão tende a zero;
e o volume tende a zero quando a pressão tende ao
infinito. Estes são os limites da lei de Boyle. Veremos,
adiante, que um gas real tem comportamento próximo ao do
gás ideal nas regiões onde a pressão tende a zero.
|
2) Volume x Temperatura: A
Lei de Charles
|
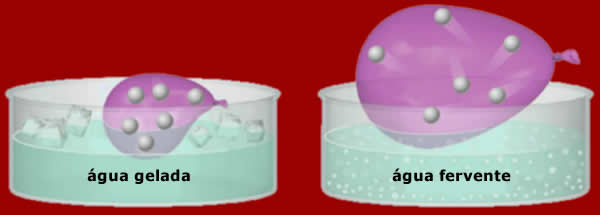
Este é um experimento que você pode fazer em casa:
encha um balão (de festa) até metade de sua capacidade.
Depois, prepare duas bacias (ou panelas) com água gelada
(água+gelo) e água quente (fervente, cuidado!). A
seguir, mergulhe o balão na água gelada. Observe seu
volume. Repentinamente, transfira o balão para o
recipiente com água quente: viu o volume do balão
aumentar? Pois é, Jacques Charles também observou este
fenômeno, lá por meados do século XVIII. E,
estabelecendo uma relação precisa
entre o volume e a temperatura dos gases,
nasceu o que hoje conhecemos como a Lei de Charles.
|
Jacques Charles,
1746- 1823
|
 Charles gostava de voar de balões de ar quente;
inventou vários equipamentos de vôo, muitos
baseados em propriedades dos gases. Estudou a
relação entre temperatura e volume de 10
diferente gases, isto em 1780!
Charles gostava de voar de balões de ar quente;
inventou vários equipamentos de vôo, muitos
baseados em propriedades dos gases. Estudou a
relação entre temperatura e volume de 10
diferente gases, isto em 1780!
|
Numa extensão do experimento acima, você pode provocar uma
diminuição ainda mais drástica do volume do balão caso tenha
um refrigerante, tal como nitrogênio líquido. Neste caso, o
balão fica com aparência de "vazio", tamanha a diferença de
temperatura. Isto porque, tal como observado por Charles,
o volume de um gás é diretamente proporcional à temperatura,
desde que a pressão do gás seja constante.
Então, se a pressão for constante:
V = constante.T
Em outras palavras, pode-se dizer que o
quociente V/T é constante (se p for
constante). Logo, qualquer variação na temperatura acarreta
uma mudança tal no volume de maneira que o quociente V/T
continue constante.Ou seja, numa mudança de T1 até T2, o
volume varia de forma que V1/T1=V2/T2..
A Figura abaixo ilustra um experimento onde
o volume de um gás foi medido em função da temperatura, em 3
pressões diferentes (A, B e C). Cada coleção de pontos forma
uma reta, que são chamadas de curvas
isobáricas de Charles para o gás ideal.
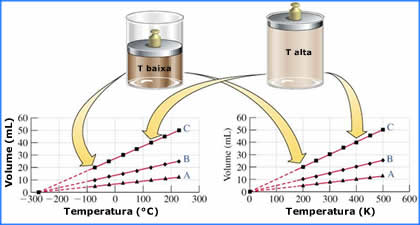
Entretanto, o fato mais impressionante visto nas isobáricas
de Charles, é o que acontece quando se extrapola as curvas
para temperaturas menores: todas, independentemente da
pressão, culminam no mesmo valor de T para o volume zero:
-273,15 °C. De acordo
com seus experimentos (que mais tarde foram confirmados e
publicados por outro francês, o Joseph-Louis Gay-Lussac), um
gás teria um volume nulo (zero) se a temperatura for de
-273,15 °C. Como qualquer volume menor do que isso é
impensável, então pode-se concluir que
esta temperatura é a menor possível de ser
atingida. Esta temperatura é chamada de zero absoluto.
A escala absoluta da temperatura foi desenvolvida (mais
tarde) por Lord Kelvin e é conhecida, hoje, como
Escala Kelvin. Nesta escala,
-273,15 °C corresponde a 0 K. A temperatura de fusão do
gelo, então, é de +273,15 K, e a de ebulição da água é de
+373,15 K. A conversão entre as escalas pode ser feita
conforme a expressão abaixo:
T(K) = T(°C) - 273,15
|
3) Volume x número de partículas:
A Lei de Avogadro
|
 O
cientista italiano Lorenzo Romano
Amedeo Carlo Avogadro apresentou, no início
do século XIX, uma explicação perfeita para várias
observações experimentais feitas por ele mesmo e muitos
outros cientistas da época, tal como Gay-Lussac.
Contemporâneo de Avogadro, Gay-Lussac
publicou um artigo em 1809 que mostrava que todos os gases
se expandiam com o aumento da temperatura. O que chamou a
atenção de Avogadro foi que todos se expandiam na
mesma proporção, independente do tipo de gás estudado.
Para sua mente estava óbvio que, então, todos os gases, a
uma certa temperatura e pressão, deveriam conter o mesmo
numero de partículas por unidade de volume.Avogadro disse
que "volumes iguais de gases,
medidos na mesma pressão e temperatura, contém o mesmo
número de partículas". Este postulado
ficou conhecido como a Lei de
Avogadro. O
cientista italiano Lorenzo Romano
Amedeo Carlo Avogadro apresentou, no início
do século XIX, uma explicação perfeita para várias
observações experimentais feitas por ele mesmo e muitos
outros cientistas da época, tal como Gay-Lussac.
Contemporâneo de Avogadro, Gay-Lussac
publicou um artigo em 1809 que mostrava que todos os gases
se expandiam com o aumento da temperatura. O que chamou a
atenção de Avogadro foi que todos se expandiam na
mesma proporção, independente do tipo de gás estudado.
Para sua mente estava óbvio que, então, todos os gases, a
uma certa temperatura e pressão, deveriam conter o mesmo
numero de partículas por unidade de volume.Avogadro disse
que "volumes iguais de gases,
medidos na mesma pressão e temperatura, contém o mesmo
número de partículas". Este postulado
ficou conhecido como a Lei de
Avogadro.
|
Avogadro, 1780-1856
|

Amedeu era
advogado; com 16 anos terminou o doutorado em
lei eclesiástica! Logo em seguida, começou a
estudar filosofia natural e passou a ensinar
ciências. Dentre suas observações, surgiram a
Lei de Avogadro e o Número de Avogadro.
|
Hoje, a lei de avogadro é expressa em termos de uma
quantidade fixa de partículas, NA,
o número de Avogadro. Assim como uma dúzia
contém doze unidades, um mol contém o
número de Avogadro de partículas, quer sejam
íons, átomos ou moléculas. Este é um número muito grande:
6,022x1023. De acordo com
Avogadro, um mol de qualquer gás irá ocupar sempre o
mesmo volume de medido nas mesmas T e p. Nas
condições normais de temperatura e pressão (CNTP, a 273,15K
e 1,00atm), um mol de qualquer gás ocupa o mesmo
volume: 22,4 litros.
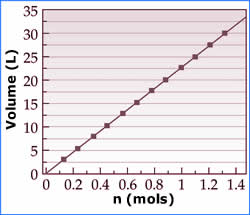
Outra observação importante de Avogadro foi de que o
volume é diretamente proporcional ao número de partículas de
gás, ou seja, quanto maior for o número de moles do
gás, maior será o seu volume, nas mesmas T e p. Isso sabemos
desde criança, ao encher um balão de festa, por exemplo: a
cada soprada, mais gás entra no balão e este fica mais
cheio, com maior volume.
Então, a Lei de Avogadro diz que:
V = constante.n
Onde n é o número de moles do gás. Em
outras palavras, o quociente V/n é constante e a relação
V1/n1=V2/n2 também é válida.
|
4) Equação de Estado dos Gases Ideais
|
A combinação dos resultados de Boyle, Charles,
Gay-Lussac e Avogadro resulta numa das mais belas
equações matemáticas da físico-química. Uma equação simples:
de apenas 4 variáveis, que parece reger o comportamento
padrão de todos os gases conhecidos. É uma equação de
estado, pois define um estado físico-químico da matéria e
seu resultado depende sempre somente dos estados inicial e
final, e não se preocupa com o caminho utilizado para ir de
um estado a outro.
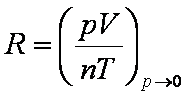 Como
vimos, combinando as 3 equações de igualdade anteriores,
temos que: Como
vimos, combinando as 3 equações de igualdade anteriores,
temos que:
pV/nT = constante
Esta constante é a constante dos
gases e é chamada de R. Seu valor é
determinado experimentalmente, fazendo-se um experimento
onde o volume de um gás é medido a várias pressões. o valor
de R, então, é obtido fazendo-se um grafico de pV/nT
vs. p; os pontos resultarão em uma reta, cujo
coeficiente linear é o melhor valor de R. Isto
porque um gás real tem comportamento de gás perfeito quando
a pressão é muito baixa.
Esta é também uma das mais famosas
equações da ciência: pV=nRT já faz parte,
praticamente, do senso comum. A expressão é poderosa: nos
permite prever qualquer estado possível para um gás, pois as
variáveis (p, V, n, T) são interdependentes e obdecem a
função pV/nT = R.
É importante lembrar que esta é uma equação empírica,
isto é, baseada somente em observações experimentais. É uma
lei: A Lei dos Gases Ideais.
Mais tarde, veremos que nem todos os gases seguem esta lei,
sobretudo em situações onde a pressão é elevada ou a
temperatura é baixa. Veremos uma outra equação de estado,
capaz de descrever também o comportamento dos gases reais.
E, assim, terminamos esta parte de nossa aula sobre o estado
gasoso. Para continuar, utilize o menu de navegação no topo
da página.
|