|

Brasil.
Pau brasil.
Da àrvore, o corante.
Das cores, o carnaval.
Nas cores, a química!
Portal de Estudos em Química (PEQ)
apresenta:
CORANTES: A Química nas Cores |
ores
sempre exerceram fascínio sobre a humanidade. Foi, talvez,
motivado pela cor (da maçã) que o homem cometeu o seu
primeiro pecado. Por toda a história, corantes
e pigmentos foram objetos de atividades comerciais.
Hoje, são mais de 8 mil compostos diferentes sendo vendidos:
substâncias que podem ser tanto orgânicas como inorgânicas.
São elas que dão cor a nossas roupas, papéis, casas, carros
ou lábios.
 Muitos
dos velhos tecidos
encontrados em múmias egipcias
eram coloridos: o uso de corantes pelo homem tem mais
de 4.000 anos! Mesmo nas cavernas, utilizávamos pigmentos
para fazer inscrições
rupestres. Muitos
dos velhos tecidos
encontrados em múmias egipcias
eram coloridos: o uso de corantes pelo homem tem mais
de 4.000 anos! Mesmo nas cavernas, utilizávamos pigmentos
para fazer inscrições
rupestres.
 Eram,
inicialmente, obtidos de fontes naturais: o uso de
corantes artificiais só iniciou em 1856. Entretanto,
muitos corantes naturais utilizados na antiguidade ainda são
empregados, e em larga escala. Exemplos são o índigo, um
pigmento azul, estraído de planta homônima (indigofera
tinctoria), a alizarina, um corante extraído da raiz de
uma planta européia (madder) e a
henna, utilizada até mesmo
na indústria de cosméticos. Nosso país deve o nome
a um corante: era do
pau brasil que se extraía um pigmento capaz de
tingir tecidos com cores fortes, como vermelho, rosa ou
marrom. Eram,
inicialmente, obtidos de fontes naturais: o uso de
corantes artificiais só iniciou em 1856. Entretanto,
muitos corantes naturais utilizados na antiguidade ainda são
empregados, e em larga escala. Exemplos são o índigo, um
pigmento azul, estraído de planta homônima (indigofera
tinctoria), a alizarina, um corante extraído da raiz de
uma planta européia (madder) e a
henna, utilizada até mesmo
na indústria de cosméticos. Nosso país deve o nome
a um corante: era do
pau brasil que se extraía um pigmento capaz de
tingir tecidos com cores fortes, como vermelho, rosa ou
marrom.
|
|
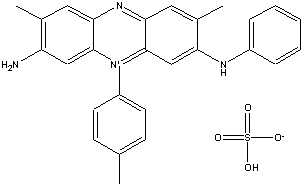
mauveína |
Em 1856, William Henry Perkin, um químico
inglês, sintetizou a
mauveina -
o primeiro corante sintético já produzido. Perkin
logo fundou uma fábrica, e logo estava produzindo
outros corantes artificiais. Hoje, mais de
90% dos corantes
empregados são sintéticos.
 Mesmo
o índigo,
um dos mais utilizados, foi obtido sinteticamente,
em 1880, e as plantações desta planta logo deixaram
de ser um bom negócio, pois o custo para a sua
fabricação era menor do que para seu cultivo e
extração. Mesmo
o índigo,
um dos mais utilizados, foi obtido sinteticamente,
em 1880, e as plantações desta planta logo deixaram
de ser um bom negócio, pois o custo para a sua
fabricação era menor do que para seu cultivo e
extração. |
 A
maior parte dos corantes fabricados vai para a
indústria têxtil; mas as indústrias de artefatos
de couro ou de papel, indústrias alimentícias, de
cosméticos, tintas e plásticos também são usuários
importantes. Como a demanda é muito grande e diversa, os
químicos são desafiados a produzir corantes e pigmentos com
propriedades particulares; este é um grande
campo de pesquisa da química, sendo que vários
pesquisadores brasileiros trabalham nesta área. A
maior parte dos corantes fabricados vai para a
indústria têxtil; mas as indústrias de artefatos
de couro ou de papel, indústrias alimentícias, de
cosméticos, tintas e plásticos também são usuários
importantes. Como a demanda é muito grande e diversa, os
químicos são desafiados a produzir corantes e pigmentos com
propriedades particulares; este é um grande
campo de pesquisa da química, sendo que vários
pesquisadores brasileiros trabalham nesta área.
|
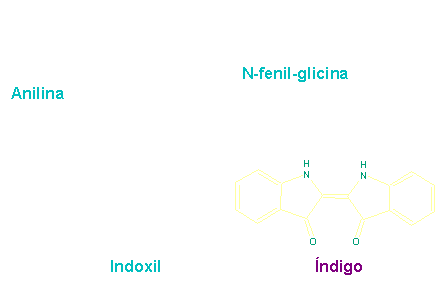
Heumann://
Síntese do índigo
|
Em 1880, Karl Heumann descobriu uma rota
sintética para um dos corantes naturais mais
utilizados: o índigo. Sua síntese envolvia a
fusão cáustica da N-fenil-glicina, que podia ser
obtida pela reação de ácido cloro acético com a
anilina.
|
|
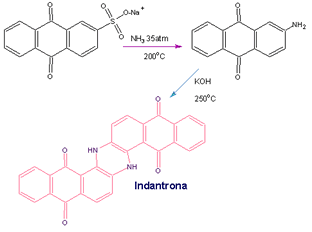
Bohn://
Indantrona
|
Para se tornar competitiva, a BASF teria que
conseguir, no início do século XX, uma opção para o
índigo, cuja síntese de Heumann estava patenteada
por outra empresa: a Bayer. O químico francês
Renè Bohn, que
havia sido orientado, no doutorado, por Heymann,
chegou à solução. Em 17 de janeiro de 1901, no seu
laboratório, Bohn chegou a uma síntese de um
composto análogo ao índigo. Ele imaginou que a rota
de Heumann deveria ser possível também em outras
aminas, não somente na anilina. Ele começou um
estudo, então, com aminas de uma série de
antraquinonas. Pela fusão alcalina da 2-aminoantraquinona
ele obteve um excelente corante azul, conhecido como
indatrona, e utilizado até hoje.
 |
Nem todas as substâncias orgânicas são coloridas;
para tanto, são necessárias algumas particularidades
estruturais da molécula. As cores dos corantes e pigmentos
são devidos a absorção de
radiação eletromagnética*
na faixa da luz visível
pelos compostos.
*(A radiação eletromagnética é causada por fótons, e o
espectro eletromagnético se expande numa longa faixa de
comprimentos de onda possíveis, de cerca de 1012m.
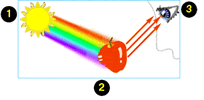
Isto corresponde a uma faixa que vai desde as ondas longas
de rádio (~10 kilômetros) aos raio-X (~10 micrômetros) e
raios gama. Nós somos aptos a detectar, com nosso corpo, uma
estreita faixa desta radiação: com nossos olhos,
detectamos a faixa de 400 a 700 nanômetros; com o tato,
somos capazes de sentir a radiação na faixa do infravermelho
e do micro-ondas, que provocam aquecimento da pele; nosso
organismo utiliza a radiação ultravioleta para promover a
formação da vitamina D, a partir de sua pró-vitamina. )

Com apenas 3 pigmentos é
possível se formar todas as cores: todo o
colorido do monitor de seu computador vem de
combinações entre vermelho, verde e azul (RGB).
|
As cores estão relacionadas com comprimentos de onda
particulares. O vermelho, por exemplo, corresponde à
faixa entre 480 a 530 nm, e o azul, de 600-700 nm.
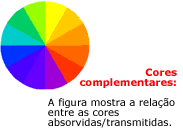 Os
compostos orgânicos podem absorver
radiação eletromagnética. É disso que se valem as
técnicas de análise de infravermelho ou espectroscopia de
ultravioleta. Entrentanto, somente compostos com várias
ligações duplas conjugadas na sua estrutura química é
que são capazes de absorver radiação na faixa da luz
visível. É a maneira e frequuência onde ocorre a absorção
que define a cor do composto: a cor observada é a
complementar à cor absorvida; os corantes pretos,
absorvem radiação na em toda a faixa visível, enquanto que
os brancos refletem toda a luz visível, e quanto mais
estreita for a faixa de absorção, mais intensa e brilhante
será a cor apresentada. Isto, sem dúvida, contribuiu para a
popularidade dos corantes sintéticos, que absorvem em
comprimentos de onda bem definidos. Os corantes naturais, em
geral, resultavam em produtos com uma cor difusa e opaca. Os
compostos orgânicos podem absorver
radiação eletromagnética. É disso que se valem as
técnicas de análise de infravermelho ou espectroscopia de
ultravioleta. Entrentanto, somente compostos com várias
ligações duplas conjugadas na sua estrutura química é
que são capazes de absorver radiação na faixa da luz
visível. É a maneira e frequuência onde ocorre a absorção
que define a cor do composto: a cor observada é a
complementar à cor absorvida; os corantes pretos,
absorvem radiação na em toda a faixa visível, enquanto que
os brancos refletem toda a luz visível, e quanto mais
estreita for a faixa de absorção, mais intensa e brilhante
será a cor apresentada. Isto, sem dúvida, contribuiu para a
popularidade dos corantes sintéticos, que absorvem em
comprimentos de onda bem definidos. Os corantes naturais, em
geral, resultavam em produtos com uma cor difusa e opaca.
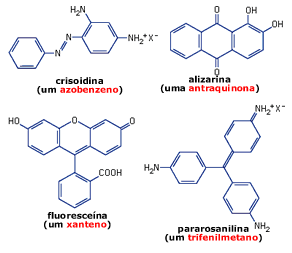 |
Estruturalmente, um dos únicos aspectos comuns a
praticamente todos os corantes é a presença de um ou mais
anéis benzênicos; por isso, estes compostos são também
chamados de benzenóides. Os primeiros corantes sintéticos
eram derivados do
trifenilmetano, que em geral era obtido a partir
da anilina ou da toluidina. Logo após, vários
químicos começaram a trabalhar com derivados da
antraquinona para
a preparação de corantes. Hoje, este é o segundo maior
grupo de corantes utilizados. Em 1901, Bohn
produziu um substituto para o índigo, a partir da 2-aminoantraquinona.
A BASF, empresa onde Bohn trabalhava, logo começou
uma longa série de corantes análogos, e muitos são vendidos
até hoje. Em torno da mesma época, o químico alemão
Adolph von Baeyer descobriu que o aquecimento do
anidrido ftálico com resorcinol
(1,3-di-hidroxibenzeno)
em solução aquosa produzia um novo composto, capaz de
tornar a solução muito fluorescente; por isso foi chamado
fluoresceína. Até
hoje este composto é empregado nas placas de sinalização em
rodovias brasileiras. Vários derivados da fluoresceína são
hoje utilizados como corantes, tal como a eosina (tetrabromofluoresceína),
que é largamente empregado como corante vermelho em
cosméticos, tintas e papéis. Seu análogo eritrosina (tetraiodofluoresceína)
é usado como corante vermelho em alimentos. A
fluoresceína é um xanteno,
uma classe de compostos largamente empregados como corantes.
|
alguns corantes comuns e suas
cores |
Os corantes azóico
são outro grupo bastantes utilizados. Em comum, eles contém
o grupo -N=N-,
chamado "azo". A reação do ácido nitroso (HONO) com
uma anilina Ar-NH2 dá o
íon diazônio Ar-N=N+,
que rapidamente reage com outras anilinas ou fenóis para
formar compostos azóico.
|
O primeiro corante azóico utilizado
comercialmente foi a
crisoidina, que já vem sendo vendido
desde 1875.
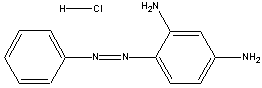
crisoidina
A partir deste, se obteve um dos corantes marrons
mais empregados: o marrom
Bismark.
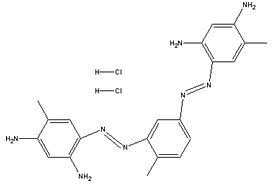
Marrom Bismark |
Os corantes azóicos podem
ser gerados no próprio tecido: o primeiro corante
direto foi o Congo Red.
Neste processo, o sal de diazônio do corante precisa reagir
com uma outra molécula para formar o corante azóico. O
tecido é previamente tratado com uma solução desta
molécula de acoplamento, e, então, imerso em uma solução
do sal de diazônio, e formar o corante diretamente no
tecido. Este método foi patenteado em 1880; um outro
processo similar, onde o tecido é inicialmente mergulhado em
uma solução do sal de diazônio e, só depois, imerso em uma
solução da molécula de acoplagem, foi patenteado sete anos
mais tarde. A maior parte dos corantes empregados neste
método eram derivados da anilina.
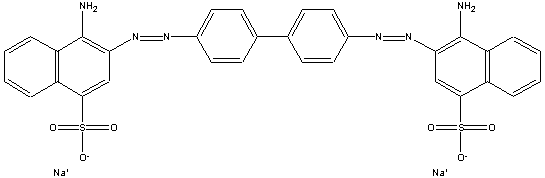
congo red
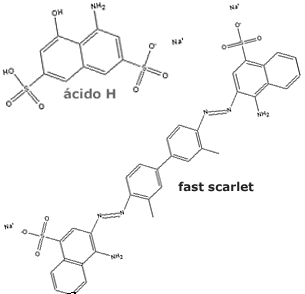 Em
1912, descobriu-se que o composto 2-hidróxi-3-naftanilida
(Naftol AS)
pode formar um íon soluvél em água, com bastante afinidade
pelo algodão. Ele poderia reagir com um componente diazóico,
e formar vários corantes largamente empregados. Um deles é o
Fast Scarlet,
como visto na figura ao lado. Durante o tingimento do
tecido, as indústrias têm à mão mais de 100 tipos de Naftol
AS e mais de 100 tipos do componente diazóico; o número de
combinações possíveis é muito grande, entretanto somente
algumas combinações é que são, de fato, utilizadas. Em
1912, descobriu-se que o composto 2-hidróxi-3-naftanilida
(Naftol AS)
pode formar um íon soluvél em água, com bastante afinidade
pelo algodão. Ele poderia reagir com um componente diazóico,
e formar vários corantes largamente empregados. Um deles é o
Fast Scarlet,
como visto na figura ao lado. Durante o tingimento do
tecido, as indústrias têm à mão mais de 100 tipos de Naftol
AS e mais de 100 tipos do componente diazóico; o número de
combinações possíveis é muito grande, entretanto somente
algumas combinações é que são, de fato, utilizadas.
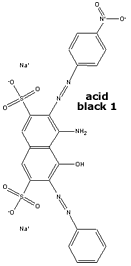
Os grupos -OH e
-NH2,
em um anel benzênico, direcionam a
acoplagem com sal de diazônio
para as posições ortho e para;
estes efeitos dependem do pH, pois ambos grupos são
ionizáveis. O ácido-H
(ácido 8-amino-1-naftol-3,6-dissulfônico)
tem estes grupos e pode ser acoplado seletivamente a
dois componentes azóicos diferentes. O corante
Acid Black 1 é obtido pela acoplagem com o íon
diazônio da p-nitroanilina, em um solução
ligeiramente ácida. Só então é adicionada a outra solução,
alcalina, com o íon diazônio da anilina.
Os mais importantes
cromógenos do século XX foram, sem
dúvida, os derivados das
ftalocianinas, introduzidos em 1934. Estes
compostos são análogos duas porfirinas naturais: a
clorofila e a hemoglobina. As
ftalocianinas, tal como as porfirinas, formam complexos
com metais, e os complexos com cobre são os mais
importantes. Estes pigmentos exibem cores fortes, brilhantes
e resistentes. A clorofila também poderia ser utilizada como
pigmento, mas sofre a decomposição pela ação da luz solar ou
calor. Outro grupo de corantes que também apareceu no século
passado foram os derivados da
quinacridona. Este
composto é utilizado como um corante violeta; o análogo
dicloro é rosa e o análogo dimetil é vermelho.
|
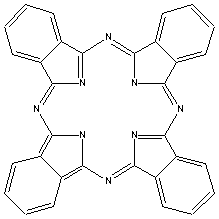
ftalocianina |
quinacridona |
Em 1956, um novo método para a introdução de corantes
no tecido foi patenteado: os
corantes reativos.
Neste processo, um grupo reativo é introduzido no corante;
este, então, liga-se covalentemente às moléculas das fibras
do tecido, principalmente o algodão. Os primeiros corantes
reativos tinham um grupo diclorotriazina
(triazina é um heterociclo
com 3 átomos de carbono e 3 de nitrogênio). Os átomos
de cloro deste composto podem ser substituídos por grupos
-OH ou -NH2; é isto o
que acontece, quando o corante reage com a fibra: os cloros
são substituídos pels grupos hidroxilas da celulose
(algodão) ou aminos das proteínas (lã).

corante reativo
corante-SO2-CH=CH2
+ HO-celulose 
corante-SO2-CH2CH2-O-celulose
|
A Hoechst desenvolveu outro tipo de corantes
reativos, onde as moléculas dos corantes são conectadas a um
grupo reativo de
vinilsulfona (VS).
Hoje, muitos corantes existem na forma reativa. Foi só com a
introdução desta técnica que o algodão pôde ser tingido com
cores fortes e vivas.
|
Do que são feitos os
tecidos?
|
Os tecidos são feitos de
fibras - naturais ou sintéticas - que são
constituídas de longas cadeias poliméricas. A lã, a
seda e o couro são polímeros
de alfa-amino-ácidos, RCH(NH2)COOH,
onde R é um grupo orgânico. Os monômeros são unidos
por ligações amídicas (-CO-NH-), separados por um
carbono do grupo R. Estes grupos podem ser
hidrofílicos, hidrofóbicos, ácidos ou básicos,
podendo servir como sítios para interações
eletrostáticas com os corantes.
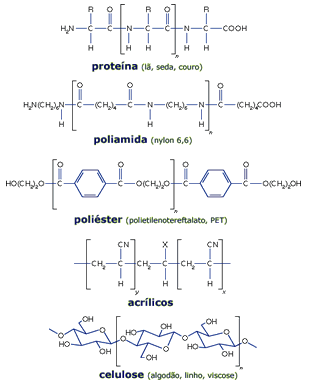
As poliamidas
(nylons) são análogos sintéticos, também com a
ligação amídica, separadas por cadeias
hidrocarbônicas lineares (CH2)n, e podem ser feito
com excessos de grupos amino ou carboxilato nos
terminais das cadeias; estes, e as ligações amídicas,
são os sítios para interações com os corantes.
Vários outras fibras sintéticas são utilizadas,
tanto para tecidos ou em plásticos, como o
poliéster e os
acrílicos.
A celulose é um
polímero linear, encontrado em plantas. É uma cadeia
formada por algumas milhares de moléculas de
beta-glucose. As fibras de algodão são praticamente
100% de celulose. A madeira contém apenas cerca de
40%, mas a celulose pode ser extraída e, então,
regenerada, podendo resultar na viscose ou no rayon.
A acetilação da celulose leva ao acetato de
celulose, outra fibra muito utilizada. |
Os plásticos, as fibras naturais e o papel tendem a
escurecer ou amarelar com o tempo, devido a fraca
absorção de luz na faixa dos 400 nm por certos grupos:
peptídeos na lã ou na seda, flavonóides na celulose, e
produtos de decomposição em polímeros. Os químicos
encontraram uma solução para este problema: a adição de um
composto fluorescente que absorve radiação UV e emite luz
visível - também na faixa de 400 nm. Assim, o efeito do
envelhecimento é mascarado. Estes compostos são conhecidos
como branqueadores ópticos,
e são utilizados em papéis, tecidos, detergentes, sabões e
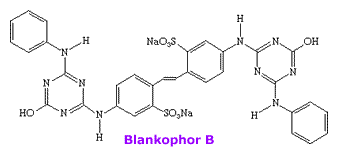
polímeros. A maioria destes branqueadores contém grupos
stilbeno ligados a unidades de triazina, como o
BlackophorB, um
dos mais utilizados.
 Os corantes são aplicados, geralmente, com um banho, do
tecido, em uma solução aquosa do corante. Este deve
migrar para a fase sólida (tecido) e não sair com adição de
água (senão a roupa desbotaria a cada lavada!). A
retenção das partículas do
corante pelas fibras do tecido envolve várias
forças atrativas, incluindo interação iônica, forças de
Van der Waals e ligação hidrogênio.
Os corantes são aplicados, geralmente, com um banho, do
tecido, em uma solução aquosa do corante. Este deve
migrar para a fase sólida (tecido) e não sair com adição de
água (senão a roupa desbotaria a cada lavada!). A
retenção das partículas do
corante pelas fibras do tecido envolve várias
forças atrativas, incluindo interação iônica, forças de
Van der Waals e ligação hidrogênio.
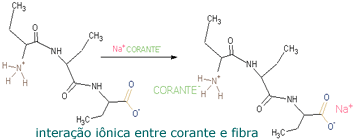
As interações iônicas
ocorrem no caso de corantes aniônicos (ácidos) ou
catiônicos (básicos); estes grupos interagem com os grupos
de polaridade oposta presente nas fibras. Algumas vezes é
necessário a adição de sais metálicos (mordante) ao
tecido; os metais complexam com os grupos polares das
fibras, resultando em sítios mais polarizados, e então aptos
a uma interação mais forte com as moléculas do corante.
 Interações
intermoleculares
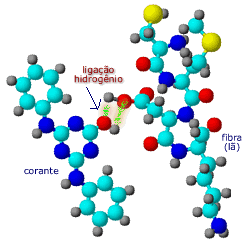
também estão presentes nas ligações fibra-corante. Tanto as
fibras como os corantes possuem grupos, com átomos O, N ou
S, altamente polares. Grupos -OH são capazes de fazer
ligações hidrogênio, a mais forte interação intermolecular.
Os grupos fenólicos, nos corantes, tem dupla função: atuam
como auxocromos e fornecem sítios para ligações hidrogênio. Interações
intermoleculares
também estão presentes nas ligações fibra-corante. Tanto as
fibras como os corantes possuem grupos, com átomos O, N ou
S, altamente polares. Grupos -OH são capazes de fazer
ligações hidrogênio, a mais forte interação intermolecular.
Os grupos fenólicos, nos corantes, tem dupla função: atuam
como auxocromos e fornecem sítios para ligações hidrogênio.
A ligação entre a fibra e o corante pode ser, ainda, do tipo
covalente: é o
caso da interação nos corantes reativos, que são
ligados a um grupo eletrofílico, capaz de reagir
quimicamente com a fibra.
Uma nova moda entra a cada
estação: novos tecidos, novos cortes e novas
cores. É por isso que o trabalho do Químico Têxtil não pára,
e esta é uma área de pesquisa crescente na química moderna.
Como importamos, ainda, quase que todos os corantes
utilizados em nossas indústrias, é natural se esperar que
ocorram mais incentivos
financeiros para trabalhos neste campo.
|
PEQ://
Repórter |
|
 Universidade
em SC oferece curso de
Química
Têxtil Universidade
em SC oferece curso de
Química
Têxtil
O PEQ visitou um dos laboratórios do curso
de Química Têxtil da FURB,
em Blumenau. A FURB é a única
instituição que oferece esta habilitação em
SC, e uma das poucas no Brasil. A região de
Blumenau possui várias indústrias têxteis -
uma vocação natural para o químico é
justamente vir a trabalhar nesta área. A
grade curricular para o químico têxtil
contém, além das tradicionais disciplinas
dos cursos de química, algumas voltadas
exclusivamente para a área têxtil e
industrial, como "Química Têxtil I, II e
III", "Indústria Têxtil I e II", "Controle
de Qualidade", "Administração I, II e
Financeira", e outras. Algumas disciplinas
são destinadas a construir, no aluno, a
preocupação com o meio ambiente, tal como
"Controle de Poluição ambiental",
"Tratamento de águas e efluentes" e "Direito
ambiental".
 O
laboratório de beneficiamento, visitado pelo
QMCWEB, conta com vários equipamentos
similares aos encontrados nas indústrias
têxteis. No laboratório se desenvolvem
vários projetos de parceria e consultoria
com indústrias da região, tal como a Hering
e a Artex. O objetivo do laboratório, além
de gerar tecnologia para a região, é o de
preparar o aluno para a realidade que ele
irá encontrar no seu trabalho, após a
conclusão do curso. Os equipamentos - de
tingimento, análise de cores, testes
físico-químicos - são praticamente os mesmos
existentes nas grandes indústrias têxteis,
porém em menor escala. Grande parte dos
alunos são absorvidos pelas indústrias mesmo
antes do término da graduação, sob a forma
de estágios. O
laboratório de beneficiamento, visitado pelo
QMCWEB, conta com vários equipamentos
similares aos encontrados nas indústrias
têxteis. No laboratório se desenvolvem
vários projetos de parceria e consultoria
com indústrias da região, tal como a Hering
e a Artex. O objetivo do laboratório, além
de gerar tecnologia para a região, é o de
preparar o aluno para a realidade que ele
irá encontrar no seu trabalho, após a
conclusão do curso. Os equipamentos - de
tingimento, análise de cores, testes
físico-químicos - são praticamente os mesmos
existentes nas grandes indústrias têxteis,
porém em menor escala. Grande parte dos
alunos são absorvidos pelas indústrias mesmo
antes do término da graduação, sob a forma
de estágios.
Maiores informações podem ser conseguidas no
site da FURB:
http://www.furb.br
|
|
Saiba mais:
|
Biblioteca:
>Leia uma excelente revisão de duas
pesquisadoras do instituto de química da
UNESP: "Corantes
Têxteis", Guaratini, C. e
Zanoni, M., Química Nova, 23(1) (2000),
página 71
>Leia o ótimo artigo "A
colourful tale": David Duff,
Chemistry in Britain, 37(1) (2001),
página 35
Internet:
>"Dye
Chemistry", da Miami University
>
A história dos corantes, de 2.600 A.C
até hoje
>
Um grande banco de dados de corantes
>
Mauveína, a molécula do mês em Bristol,
UK
>
"Os mestres da cor", no Musée des arts
et métiers
|
|
|
|