|

Já está em
fase final de testes
uma série de soluções que serão utilizadas como
substitutos sintéticos para o
sangue. Nenhum deles é, entretanto, exatamente eficaz. Surge
um novo desafio para os químicos:
preparar soluções que, além de mimetizar o comportamento do
sangue humano, não tragam nenhum agravo ao nosso organismo.
O
Portal de Estudos em Química (PEQ)
apresenta O Sangue Artificial.
 Desde
o século XVII, as transfusões de sangue tem sido
uma tentativa de remediar as perdas de sangue
causadas por traumas, partos, hemorragias e cirurgias. Antes
da identificação dos anticorpos isoaglutinantes (fator Rh),
as transfusões provocaram muitas mortes. A disponibilidade
do sangue para a transfusão sempre foi um problema. A
dificuldade era maior ainda durante as guerras:
períodos onde a pesquisa de químicos em busca de um
substituto sintético para o sangue sempre foi intensa. Desde
o século XVII, as transfusões de sangue tem sido
uma tentativa de remediar as perdas de sangue
causadas por traumas, partos, hemorragias e cirurgias. Antes
da identificação dos anticorpos isoaglutinantes (fator Rh),
as transfusões provocaram muitas mortes. A disponibilidade
do sangue para a transfusão sempre foi um problema. A
dificuldade era maior ainda durante as guerras:
períodos onde a pesquisa de químicos em busca de um
substituto sintético para o sangue sempre foi intensa.
 Os
primeiros substitutos
surgiram durante a segunda guerra mundial: os alemães
utilizavam soluções aquosas de PVP (polivinilpirrolidona).
O objetivo era apenas o de manter o volume sanguíneo, uma
vez que esta solução não era capaz de transportar
oxigênio. Durante a guerra do Vietnã, várias tentativas
foram feitas, utilizando soluções aquosas de hemoglobina ou
derivados. Embora mais eficaz do que o PVP, os efeitos
colaterais incluiam complicações renais sérias, que muitas
vezes levavam à morte. Os
primeiros substitutos
surgiram durante a segunda guerra mundial: os alemães
utilizavam soluções aquosas de PVP (polivinilpirrolidona).
O objetivo era apenas o de manter o volume sanguíneo, uma
vez que esta solução não era capaz de transportar
oxigênio. Durante a guerra do Vietnã, várias tentativas
foram feitas, utilizando soluções aquosas de hemoglobina ou
derivados. Embora mais eficaz do que o PVP, os efeitos
colaterais incluiam complicações renais sérias, que muitas
vezes levavam à morte.
Na década de 1960, Legand Clark iniciou uma pesquisa
com uma classe de compostos conhecidos como
perfluorocarbonos.
O oxigênio apresenta uma grande solubilidade nestes
líquidos: cerca de 500 vezes maior do que na água. Estes
compostos, entretanto, são bastante hidrofóbicos (imiscíveis
com a água). Foi necessário se desenvolver um sistema
emulsificante, com o auxílio de surfactantes, para
solubilizar o PFCs em água, tal como a lecitina extraída de
ovos de galinha. As emulsões atuais já são a segunda geração
de substitutos do sangue baseados em PFCs. Hoje, a grande
maioria dos substitutos sendo testados clinicamente
baseia-se em soluções de PFCs ou derivados de hemoglobina.
|
Transporte de Oxigênio
|
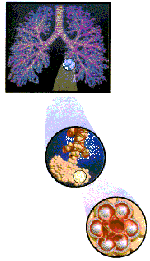 O
sangue é uma complexa mistura contendo
glóbulos vermelhos, glóbulos brancos,
plaquetas e o plasma, com eletrólitos,
albumina, fatores coagulantes e outras
proteínas. O oxigênio é um gás que apresenta
baixa solubilidade em água. No plasma
sanguíneo, ele é solúvel graças a ação de
certas proteínas (hemoglobinas) encontradas
em alguns eritrócitos. As hemoglobinas são
tetrâmeros que possuem complexos heme-Fe,
capaz de se coordenar à molécula de
oxigênio. Esta ligação entre o complexo heme
e a molécula de oxigênio é fraca e instável:
depende de uma série de fatores, como pH,
temperatura e, principalmente, da pressão
parcial de O2 na
qual a hemoglobina se encontra. A estrutura
da hemoglobina permite que ela se ligue a 4
moléculas de O2
simultaneamente. O
sangue é uma complexa mistura contendo
glóbulos vermelhos, glóbulos brancos,
plaquetas e o plasma, com eletrólitos,
albumina, fatores coagulantes e outras
proteínas. O oxigênio é um gás que apresenta
baixa solubilidade em água. No plasma
sanguíneo, ele é solúvel graças a ação de
certas proteínas (hemoglobinas) encontradas
em alguns eritrócitos. As hemoglobinas são
tetrâmeros que possuem complexos heme-Fe,
capaz de se coordenar à molécula de
oxigênio. Esta ligação entre o complexo heme
e a molécula de oxigênio é fraca e instável:
depende de uma série de fatores, como pH,
temperatura e, principalmente, da pressão
parcial de O2 na
qual a hemoglobina se encontra. A estrutura
da hemoglobina permite que ela se ligue a 4
moléculas de O2
simultaneamente.
Quando o sangue chega aos alvéolos
pulmonares, a hemoglobina encontra as
condições ideias para a interação com o O2
(alta pressão parcial do gás, baixa pressão
do CO2, etc.).
Quando, através da circulação, chega aos
tecidos, encontra uma região onde a pressão
parcial de CO2 é
maior do que a de O2.
Além disso, o excesso de CO2
dissolvido no plasma, nestas regiões, faz
com que o pH seja ligeiramente menor, o que
favorece a liberação do O2
pela hemoglobina. O O2
vai para as células e, então, o CO2
é que interage com a hemoglobina, que o leva
até os alvéolos pulmonares, onde, novamente,
interage com O2.
A solubilidade dos gases em líquidos foi
estudada por Henry, que formulou um modelo,
chamado de "Lei de Henry das Pressões
Parciais". Este é um dos tópicos estudados
nas disciplinas de Química Geral.
|
|
|
Problemas com
Perfluorocarbonos
- PFCs
|
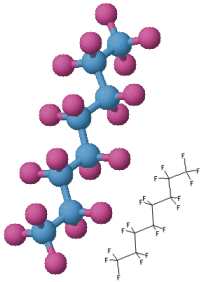
Desde a década de 1960 sabia-se que mamíferos podiam
sobreviver submersos em líquidos orgânicos
(Clark LC, Jr, Gollan F. Survival of
mammals breathing organic liquids equilibrated with oxygen
at atmospheric pressure. Science 152:1755, 1966).
Um dos mais promissores sistemas de sangue artificial são os
baseados em fluorocarbonetos: moléculas formadas de carbono
e flúor. Os perfluorocarbonos são
biologicamente inertes.
Quando administrados na corrente sanguínea, eles são capazes
de aumentar a solubilidade do O2
no plasma. As moléculas dos PFCs são posteriormente
sequestradas pelo sistema retículo-endotelial, mais
precisamente pelas células de Kupffer, no fígado, e
subsequentemente liberadas no plasma, como um gás
dissolvido.
 O
gás é então exalado, sem qualquer metabolização, pelos
pulmões. A liberação é lenta: após uma transfusão, o
paciente pode exalar PFC por mais de 10 meses! O
gás é então exalado, sem qualquer metabolização, pelos
pulmões. A liberação é lenta: após uma transfusão, o
paciente pode exalar PFC por mais de 10 meses!
Mesmo a atual geração de PFC permanece cerca de 7 dias no
fígado, um tempo bem menor, entretanto, de que os primeiros
substitutos baseados em PFC. Isto permite uma eliminação
efetiva, sem nenhum dano ou disfunção no órgão.
 Entretanto
- apesar de inertes - o sequestro dos PFCs pelo fígado pode
causar sérias consequências. A contagem de plaquetas
diminui: os PFCs "solvatam" as plaquetas, que são
sequestradas, juntamente, para o fígado. E, se o volume de
sangue na transfusão for muito grande, as moléculas de PFC
podem saturar e prejudicar o funcionamento do fígado,
resultando em uma potencial infecção ou outras complicações.
Atualmente, o volume seguro de PFC em uma transfusão é de,
no máximo, 1 litro. Entretanto
- apesar de inertes - o sequestro dos PFCs pelo fígado pode
causar sérias consequências. A contagem de plaquetas
diminui: os PFCs "solvatam" as plaquetas, que são
sequestradas, juntamente, para o fígado. E, se o volume de
sangue na transfusão for muito grande, as moléculas de PFC
podem saturar e prejudicar o funcionamento do fígado,
resultando em uma potencial infecção ou outras complicações.
Atualmente, o volume seguro de PFC em uma transfusão é de,
no máximo, 1 litro.
Outra propriedade dos PFCs é a
forte dependência com a Lei de Henry das pressões
parciais: a solubilidade do O2
depende intensamente da sua pressão parcial, e o oxigênio
não tem solubilidade funcional se a pressão deste gás for
igual a observada no ar atmosférico. A respiração do
paciente pós transfusão deve ser artificial, com uma
mistura de gáses onde a concentração de O2
é maior do que a atmosférica. A pressão parcial de O2
deve ser de, no mínimo, 400 mmHg!
Um dos produtos já em teste é o PERFLORAN, desenvolvido pelo
Institute of Theoretical and Experimental Biophysics em
Pushchino, Russia. As principais características deste
produto são:
 |
pode ser armazenado em temperaturas entre -5oC
a -18oC, até por dois
anos;
|
 |
solubiliza tanto o O2
como o CO2;
|
 |
pode ser administrado com soluções salinas,
albumina, glucose e antibióticos;
|
 |
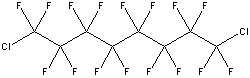
os principais componentes são o perfluorodecalina
(PFD) C10F18
and perfluorometilciclo-hexilpiperidina (PFMCP) C12F23N.
|
|
Por que não usar a
Hemoglobina?
|
Embora tenha sido uma das primeiras e infrutíferas
alternativas, mesmo hoje a hemoglobina tem sido alvo de
pesquisa para a sua utilização como
 substituto
do sangue. Pode ser extraída de sangue coletado nas salas de
cirurgia, de amostras de sangue para doação descartadas e,
mesmo, de outros animais. Em todos os casos se obtém uma
"hemoglobina" extremamente tóxica para nosso organismo. substituto
do sangue. Pode ser extraída de sangue coletado nas salas de
cirurgia, de amostras de sangue para doação descartadas e,
mesmo, de outros animais. Em todos os casos se obtém uma
"hemoglobina" extremamente tóxica para nosso organismo.
Hemoglobina é um tetrâmero
protéico, que é encontrada no sangue encapsulada
em um eritrócito
(uma célula sanguínea), conhecido como "glóbulo vermelho".
Fora destas células, a molécula rapidamente se dissocia em
dímeros, compostos de uma unidade alfa e outra beta. Além de
perder a funcionalidade, esta hemoglobina é filtrada pelos
rins e, ao interagir com as paredes celulares dos glomérulos
renais, causa uma rápida necrose tubular e consequente
colapso da função renal.
O desafio,
então, é produzir uma
hemoglobina tetrâmera que não se dissocie em dímeros
na infusão. Este problema tem sido resolvido de várias
maneiras.
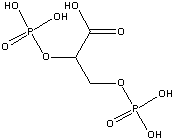 A
prevenção da dissociação do tetrâmero da hemoglobina, no
plasma, tem sido feita pela ligação das subunidades, tanto
quimicamente como geneticamente. A ligação química envolve a
união das subunidades alfa por um "agente bifuncional", tal
como a diaspirina, que une as moléculas de hemoglobina,
estabilizando-as. Estas poli-hemoglobinas estão, agora, na
fase de testes clínicos. O problema principal deste método é
a falta do 2,3PG
(ácido 2,3-difosfo-D-glicérico)
associado com a hemoglobina, tal como acontece
nos glóbulos vermelhos. Isto faz com que as
poli-hemoglobinas tenham uma afinidade pelo O2 menor do que
as hemoglobinas encapsuladas nos glóbulos vermelhos. A
prevenção da dissociação do tetrâmero da hemoglobina, no
plasma, tem sido feita pela ligação das subunidades, tanto
quimicamente como geneticamente. A ligação química envolve a
união das subunidades alfa por um "agente bifuncional", tal
como a diaspirina, que une as moléculas de hemoglobina,
estabilizando-as. Estas poli-hemoglobinas estão, agora, na
fase de testes clínicos. O problema principal deste método é
a falta do 2,3PG
(ácido 2,3-difosfo-D-glicérico)
associado com a hemoglobina, tal como acontece
nos glóbulos vermelhos. Isto faz com que as
poli-hemoglobinas tenham uma afinidade pelo O2 menor do que
as hemoglobinas encapsuladas nos glóbulos vermelhos.
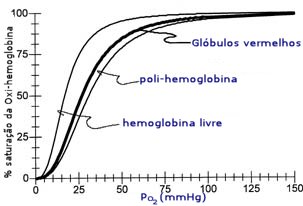
Saturação das oxi-hemoglobinas para 3 sistemas
diferentes, em função da pressão parcial de O2.
|
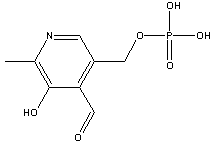 Esta
afinidade pode ser medida pelo parâmetro P50, que
corresponde à pressão parcial de O2
necessária para saturar 50% das moléculas de hemoglobina.
Quanto maior for o valor de P50, maior será a capacidade
para o transporte de O2. Para uma
solução de hemoglobina (fora dos glóbulos vermelhos), a P50
é de aproximadamente 17 mmHg. A P50 para a hemoglobina
natural, no sangue, é de 27 mmHg. Esta
afinidade pode ser medida pelo parâmetro P50, que
corresponde à pressão parcial de O2
necessária para saturar 50% das moléculas de hemoglobina.
Quanto maior for o valor de P50, maior será a capacidade
para o transporte de O2. Para uma
solução de hemoglobina (fora dos glóbulos vermelhos), a P50
é de aproximadamente 17 mmHg. A P50 para a hemoglobina
natural, no sangue, é de 27 mmHg.
Esta marca já foi ultrapassada quimicamente, pela
polihemoglobina ligada por moléculas de
fosfato de piridoxal
(3-hidroxi-2-metil-5-[(fosfonooxi)metil]-4-Piridinocarboxaldeído).
A P50 para uma solução desta polihemoglobina é de mais de
30mmHg!
|
OxigêniO
|
O oxigênio que respiramos é um gás
formado por moléculas compostas por dois
átomos do elemento Oxigênio, cuja
fórmula molecular é O2.
Cerca de 20% de nossa atmosfera é o gás
O2, enquanto
que, em Marte, este gás ocupa apenas
0,15% da atmosfera. O oxigênio é o
terceiro elemento mais abundante no sol;
a massa deste elemento em um corpo
humano corresponde a cerca de 2/3 da
massa total do corpo. Os estados
excitados dos elétrons da molécula de O2
é que são responsáveis pelas cores
vermelho e verde-amarelado da aurora,
que é visível nos polos. O gás é
incolor, enquanto que tanto o sólido
quanto o líquido são azulados. Embora
não apresente elétrons desemparelhados,
de acordo com o molelo LCAO, o O2
é uma molécula paramagnética. Isto
intrigou muitos químicos por vários
anos, até o surgimento do modelo de
Orbital Molecular: seus elétrons
desemparelhados são vistos na
distribuição eletrônica da molécula
segundo este modelo:
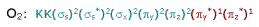
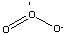
Uma outra forma de oxigênio molecular é
o seu alótropo ozônio, cuja fórmula
molecular é O3.
 É
formado a partir de descargas elétricas
ou luz ultravioleta agindo sobre o O2.
Apesar de nos proteger contra a radiação
vinda do sol, o ozônio é um gás
extremamente tóxico, se inalado. É
formado a partir de descargas elétricas
ou luz ultravioleta agindo sobre o O2.
Apesar de nos proteger contra a radiação
vinda do sol, o ozônio é um gás
extremamente tóxico, se inalado.
 Este
gás não é muito solúvel em água: o CO2
é 29 vezes mais solúvel do que o O2!
O O2 é uma
molécula apolar - daí a sua afinidade
com PFCs. Este
gás não é muito solúvel em água: o CO2
é 29 vezes mais solúvel do que o O2!
O O2 é uma
molécula apolar - daí a sua afinidade
com PFCs.
|
|
Uma outra técnica é a modificação genética da hemoglobina.
Com o auxílio da bactéria E. Coli, pode-se produzir
grandes quantidades de uma hemoglobina geneticamente
alterada, contendo uma mutação proposital: a adição de
alguns amino ácidos à sequência, que permitem a ligação
covelente entre as duas subunidades alfa, impedindo a
dissociação do tetrâmero. A P50 para estas hemoglobinas
mutantes é também superior a 30 mmHg. Vários substitutos
baseados nesta técnica já estão em fase de testes clínicos.
Outros grupos tentam utilizar a hemoglobina bovina,
polimerizada. Uma vantagem é fonte barata e abundante de
sangue bovino. A desvantagem é o delicado processo de
descontaminação das amostras, evitando o contágio por
zoonoses.
 Na
terceira geração de substitutos
do sangue baseados em hemoglobina, a idéia é se encapsular a
proteína, tal como nos glóbulos vermelhos. A primeira
encapsulação artificial de todos os componentes das células
vermelhas, incluindo a hemoglobina e enzimas, foi feita em
1957, por Chang (Chang TMS & WP Yu(1996).
Biodegradable polymer membrane containing hemoglobin for
blood substitutes. U.S.A. Patent,1996). Chang
continuou o trabalho, utilizando vários materiais como
membrana artificial: proteínas, bicamadas de fosfolipídeos
complexadas com polímeros, membranas poliméricas, e outros.
Thomas Chang, na
McGill University, Canadá, tem produzido nanocápsulas de
cerca de 150nm de diâmetro a partir de uma membrana
polimérica biodegradável. Esta membrana é rapidamente
convertida em água e CO2 pós o
uso e não acumula no organismo, tal como acontecia com as
membranas a base de lipídeos. Na
terceira geração de substitutos
do sangue baseados em hemoglobina, a idéia é se encapsular a
proteína, tal como nos glóbulos vermelhos. A primeira
encapsulação artificial de todos os componentes das células
vermelhas, incluindo a hemoglobina e enzimas, foi feita em
1957, por Chang (Chang TMS & WP Yu(1996).
Biodegradable polymer membrane containing hemoglobin for
blood substitutes. U.S.A. Patent,1996). Chang
continuou o trabalho, utilizando vários materiais como
membrana artificial: proteínas, bicamadas de fosfolipídeos
complexadas com polímeros, membranas poliméricas, e outros.
Thomas Chang, na
McGill University, Canadá, tem produzido nanocápsulas de
cerca de 150nm de diâmetro a partir de uma membrana
polimérica biodegradável. Esta membrana é rapidamente
convertida em água e CO2 pós o
uso e não acumula no organismo, tal como acontecia com as
membranas a base de lipídeos.
|
|