INTRODUÇÃO
Você deve ter percebido que, em princípio, uma pilha pode ser construída com
base em qualquer reação de oxirredução. Apesar de produzirem uma energia
muito mais cara do que a energia gerada por outros processos, devido à sua
praticidade, as pilhas estão presentes em nosso cotidiano fazendo funcionar
os mais diversos aparelhos, tais como: lanternas, calculadoras, computadores
portáteis, brinquedos, câmaras fotográficas, câmaras de vídeo, telefones sem
fio, telefones celulares, entre outros.
HISTÓRICO
No século
XVII Otto Von Guericke inventou a primeira máquina para produzir
eletricidade.
Luigi Aloisio
Galvani na segunda metade do século XVIII começou a pesquisar a aplicação
terapêutica da eletricidade, após dez anos de pesquisa publicou: "Sobre as
forças de eletricidade nos movimentos musculares”, onde concluía que os
músculos armazenavam eletricidade do mesmo modo que uma jarra de Leiden, e
os nervos conduziam essa eletricidade. Os trabalhos de Galvani influenciaram
Alessandro Volta, que após muitas pesquisas desenvolveu um dispositivo
formado por prata e zinco ou prata e chumbo ou prata e estanho ou por cobre
e estanho, ou ainda por prata e cobre, cada par metálico era separado por um
disco de material poroso embebida em uma solução de sal, o disco inferior
era sempre de prata e o superior de zinco, essas placas terminais eram
ligadas por fios metálicos para conduzir a eletricidade produzida. Davy em
1812 produziu um arco voltaico usando eletrodos de carvão ligados a uma
bateria de muitos elementos.
As pilhas
elétricas foram idealizadas por Alessandro Volta em 1800. A chamada pilha de
Volta consta de uma sobreposição de discos de cobre e zinco, soldados dois a
dois e dispostos na mesma ordem, ficando cada par separado do imediato por
uma rodela de pano ou de cartão embebida em água acidulada como ácido
sulfúrico. Volta notou entre as placas da base e as do alto, uma diferença
de potencial que dava origem a fenômenos elétricos. Este foi o ponto de
partida para a construção das pilhas elétricas. A pilha é um gerador
químico, isto é, transforma energia química em energia elétrica.

Pilha de Volta
Como exemplo de pilhas, podemos citar:
I)
PILHAS SECAS
Os
principais tipos são as de zinco-carvão, as alcalinas, as de mercúrio e as
de lítio.
PILHA DE ZINCO-CARVÃO
Inventada em 1865 por Georges Leclanché e, por isso, é também conhecida como
Pilha de Leclanché. Fornece uma voltagem de 1,5 V, tem baixo custo de
produção, sendo largamente utilizada em lanternas, brinquedos, rádios
portáteis, etc.
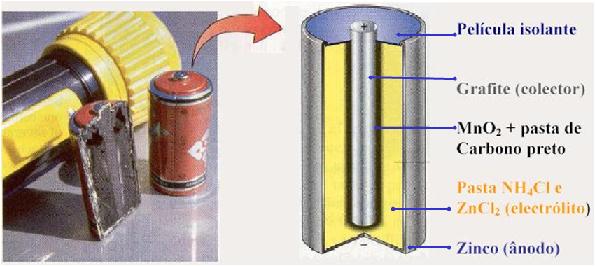
Neste tipo de pilha, o ânodo (pólo negativo) é o zinco, enquanto o cátodo
(pólo positivo) é o MnO2, presente na pasta interna da pilha. A
barra de grafite funciona como coletora da corrente catódica, e o eletrólito
é a pasta externa constituída de cloreto de amônio (NH4Cℓ),
cloreto de zinco (ZnCℓ2)
e água.
As
semi-reações que ocorrem não estão totalmente esclarecidas, mas podem ser
resumidas da seguinte forma:
ÂNODO: Zn →
Zn2+ + 2e-
CÁTODO: 2 MnO2 + 2 NH4+ + 2e-
→
Mn2O3
+ 2 NH3 + H2O
REAÇÃO GLOBAL:
Zn + 2 MnO2 + 2 NH4+
→
Zn2+ +
Mn2O3
+ 2 NH3
Esta pilha não funciona totalmente a seco, haja vista que as pastas contidas
no seu interior são úmidas, cessando o seu funcionamento quando o MnO2
for totalmente consumido. Este tipo de pilha não pode ser recarregada.
PILHA ALCALINA

É
semelhante à de Leclanché. O ânodo é constituído de zinco poroso, que
facilita uma oxidação mais rápida, e o eletrólito contém KOH em vez de NH4Cℓ,
por isso o nome de alcalina.
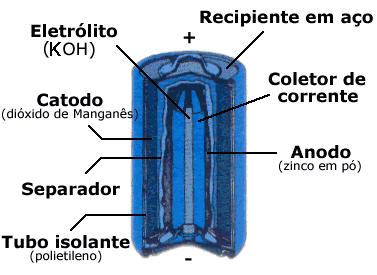
As
semi-reações que ocorrem são:
ÂNODO: Zn + 2 OH-
→
ZnO + H2O + 2e-
CÁTODO: 2 MnO2 + H2O + 2e-
→
Mn2O3 + 2 OH-
REAÇÃO GLOBAL:
Zn + 2 MnO2→
ZnO +
Mn2O3
Este tipo de pilha fornece uma voltagem de 1,5 V, não é recarregável; porém,
é mais eficiente que a de Leclanché, pois tem uma vida útil maior, mantém a
voltagem constante por mais tempo e produz 50% a mais de energia. Estas
vantagens ocorrem porque o KOH é melhor eletrólito que a solução de NH4Cℓ
e ZnCℓ2,
resultando em uma menor resistência interna da pilha. São muito utilizadas
em lanternas, rádios portáteis, brinquedos, etc.
PILHA DE MERCÚRIO

Neste tipo, o ânodo é de zinco e o cátodo é de óxido de mercúrio (HgO). O
eletrólito é uma pasta que contém KOH, Zn(OH)2 e HgO.
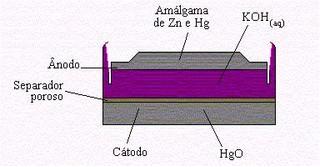
As
semi-reações que ocorrem são:
ÂNODO: Zn + 2 OH-
→
ZnO + H2O + 2e-
CÁTODO: HgO + H2O + 2e-
→
Hg + 2 OH-
REAÇÃO GLOBAL:
Zn + HgO →
ZnO + Hg
Não é recarregável, apresenta tamanho diminuto (geralmente em forma de
botão), boa capacidade de armazenar energia, vida longa, e voltagem de 1,35
V. É utilizada em dispositivos de grande sensibilidade, como aparelhos de
surdez, relógios de pulso, calculadoras portáteis, etc.
PILHA DE LÍTIO

Utilizada como marca-passo cardíaco (pacemaker), é constituída por uma
cápsula de titânio pequeno e muito leve que contém um sistema eletrônico que
gera impulsos elétricos de freqüência fixa ou programável. Os impulsos
elétricos gerados pelo marca-passo chegam até o coração através de um fio
colocado em um vaso sanguíneo, regularizando, assim, as batidas cardíacas.
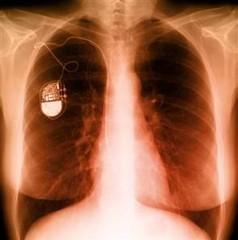
Pacemaker ou
marca-passo é um dispositivo pequeno (bateria ou “pilha”),
implantado na zona peitoral, por baixo da pele, que emite
estímulos de baixa intensidade através de sondas
introduzidas no coração. Consequentemente, o músculo
cardíaco é estimulado de forma a manter ou a regular o ritmo
cardíaco.
Uma dessas pilhas é a pilha de lítio-iodo, cujo funcionamento baseia-se nas
semi-reações:
ÂNODO: 2 Li
→ 2
Li1+ + 2e-
CÁTODO: I2 + 2e-
→
2 I1-
REAÇÃO GLOBAL: 2 Li + I2
→ 2 LiI
Características: é extremamente leve, não emite gases, produz uma voltagem
de 2,8 V, dura de 5 a 8 anos e não pode ser recarregada.
II) ACUMULADORES
São uma associação de pilhas ou elementos ligados em série. Como principais
exemplos, podemos citar a bateria de níquel-cádmio e as baterias ou
acumuladores de chumbo.
BATERIA DE NÍQUEL-CÁDMIO


O
ânodo é o cádmio, enquanto o cátodo contém óxido de níquel IV (NiO2).
O eletrólito é o hidróxido de potássio (KOH), e as semi-reações que ocorrem
são:
ÂNODO: Cd + 2 OH-
→
Cd(OH)2 + 2e-
CÁTODO: 2 NiO2 + 2 H2O + 2e-
→
2 Ni(OH)2 + 2 OH-
REAÇÃO GLOBAL:
Cd + 2 NiO2 + 2 H2O→
Cd(OH)2 +
2 Ni(OH)2
Com o tempo, os hidróxidos de cádmio e níquel, que são insolúveis, acabam
por se depositar nos eletrodos, fazendo com que a bateria pare de funcionar.
Fornecendo energia elétrica de uma fonte externa, conseguimos inverter a
reação e regenerar o Cd e o NiO2, o que faz a bateria funcionar
novamente.
Características: fornece uma voltagem constante de 1,4 V e pode ser
recarregada um grande número de vezes.
Utilização: aparelhos elétricos sem fio, tais como: câmaras de vídeo,
telefones, barbeadores, etc.
BATERIA DE NÍQUEL-METAL HIDRETO (Ni-MH)

Também denominadas de Níquel Metal Hidreto, as pilhas NiMH são o
tipo mais usado atualmente, pois oferecem maior capacidade, maior tempo de
vida, suportam mais recargas se comparado ao NiCd (dependendo do fabricante,
isso pode não ser verdadeiro) e são menos poluentes, já que não utilizam
materiais pesados, como o cádmio. Outra vantagem desse tipo é a não
existência do efeito memória.
As
semi-reações que ocorrem são:
ÂNODO: MH + OH-
→ M
+ H2O + 1e-
CÁTODO: NiO(OH) + H2O + 1e-
→
Ni(OH)2 + OH-
REAÇÃO GLOBAL:
MH + NiO(OH) → M
+
Ni(OH)2
BATERIA DE
ÍON
LÍTIO

Há também um tipo chamado LiIon (Lithium Íon), também
conhecido como Lítio Íon. As baterias de íon lítio são um tipo
de baterias recarregáveis muito utilizadas em equipamentos eletrônicos
portáteis. Armazenam o dobro de energia que uma bateria de hidreto metálico
de níquel (ou NiMH) e três vezes mais que uma bateria de níquel cádmio (ou
NiCd). Outra diferença da bateria de íons de lítio é a ausência do efeito
memória, ou seja, não é preciso carregar a bateria até o total da capacidade
e descarregar até o total mínimo, ao contrário da bateria de NiCd
As
semi-reações que ocorrem são:
ÂNODO: LiXC6
→ x
Li1+ + 6 C + xe-
CÁTODO: Li1-X CoO2 + x Li1+ + xe-
→
LiCoO2
REAÇÃO GLOBAL:
LiXC6 + Li1-X CoO2
→
LiCoO2 + 6 C
Observe o diagrama
esquemático das reações químicas da bateria de íon lítio:
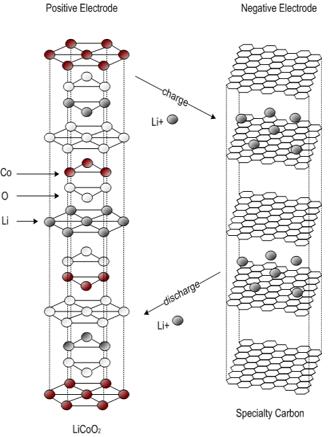
BATERIA DE
ZINCO-AR

As pilhas
de zinco-ar são a mais recente tecnologia desenvolvida para o armazenamento
de energia. Este tipo de bateria funciona extraindo o oxigênio existente no
ar para reagir com o zinco e produzir eletricidade. Seu princípio de
funcionamento é semelhante ao das baterias alcalinas, que também possui
zinco no seu interior reagindo com o oxigênio para produzir energia. Porém,
nestas baterias o oxigênio é fornecido por um componente interno (dióxido de
manganês), nas baterias do tipo zinco-ar, o oxigênio vem da atmosfera, a
bateria tem várias aberturas.
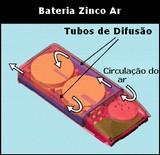
Existem
dois tipos de baterias zinco-ar: as que podem ser recarregadas e as
descartáveis. Baterias deste tipo recarregáveis (onde células de zinco são
substituídas) são utilizadas em aplicações como veículos elétricos movidos a
bateria. A grande vantagem deste tipo de bateria é sua durabilidade (tempo
de descarga), muito maior do que a dos outros tipos até hoje existentes.
As semi-reações que ocorrem na bateria de zinco-ar:
ÂNODO: Zn + 4OH– → Zn(OH)42–
+ 2e–
FLUÍDO: Zn(OH)42– → ZnO + H2O
+ 2OH–
CÁTODO: O2 + 2 H2O + 4e–
→ 4OH–
REAÇÃO GLOBAL: 2 Zn + O2 → 2 ZnO
-
SAIBA MAIS SOBRE.....
CARREGADORES

Como o nome indica, carregadores são aparelhos responsáveis por recarregar
as pilhas. O procedimento para isso freqüentemente é simples: basta colocar
um ou dois pares de pilhas recarregáveis no dispositivo e encaixá-lo em uma
tomada da rede elétrica.
Esse modo de trabalho nos faz pensar que o carregamento da pilha é
feito transferindo-se energia da rede para a pilha, tal como se tira água de
uma torneira para encher uma garrafa. Na verdade, não é tão simples assim.
O processo de recarga de pilhas consiste em passar uma corrente
elétrica por elas de forma que a energia seja "capturada" e armazenada.
Quanto maior a corrente (carregadores mais rápidos), menor é o tempo de
recarga. No entanto, a maior "velocidade de trabalho" faz com que a geração
de calor aumente, motivo pelo qual deve-se escolher um carregador capaz de
identificar quando a pilha está totalmente carregada para cortar a corrente.
O super-aquecimento pode fazer a pilha vazar e, na pior das hipóteses,
explodir.
No mercado, são mais comuns os aparelhos que fazem uma recarga mais
lenta. As vantagens desse tipo estão no preço e na diminuição drástica do
risco de super-aquecimento das pilhas. Além disso, as pilhas acabam tendo
vida útil maior.
Na escolha de um carregador, prefira os modelos que trabalham tanto
com NiCd como com NiMH. Dê preferência aos aparelhos que cortam a corrente
(na verdade, mantém uma corrente baixa para manter a energia na pilha)
quando sua carga estiver completa.
Ciclos Carga/Descarga
Os
ciclos carga/descarga definem a vida funcional das baterias. À medida que um
bateria é carregada e descarregada, a sua capacidade sofre alterações e após
um certo número de ciclos, a bateria perde a validade e não consegue
completar com sucesso as reações químicas. Uma bateria NiMH normal gasta-se
ao fim de 400 a 700 ciclos, enquanto que uma NiCd, se bem manuseada, pode
durar vários milhares de ciclos. A General Electric testou baterias NiCd
para os satélites e conseguiu baterias capazes de trabalhar durante 17 anos,
num total de 70 000 ciclos. No entanto, as baterias NiCd para celulares não
chegam sequer perto, já que a concentração dos químicos para adquirirem
grandes capacidades de energia leva à diminuição drástica dos ciclos, que
podem reduzir-se a algumas centenas. Quanto às baterias de Lítio, duram
entre 300 a 500 ciclos. Por outro lado, os recarregamentos das baterias NiMH
e Lítio demoram muito mais tempo do que as baterias NiCd.
Auto-descarregamento
As
baterias sofrem também de um efeito de auto-descarregamento, ou seja, perdem
alguma energia quando não estão sendo usadas.No geral, as baterias não
conseguem conservar toda a energia que contêm. Uma bateria de NiCd pode
perder cerca de 10% da energia nas primeiras 24 horas (embora continue a
perdê-la apenas a 10% por mês), e as baterias de NiMH têm uma taxa de
auto-descarregamento ainda maior, devido aos átomos de Hidrogênio em fuga.
Porém, se o auto-descarregamento for muito alto a bateria pode estar
danificada. Um dos problemas pode ser um separador danificado, o que é
irreparável. Normalmente, uma bateria com uma taxa de auto-descarregamento
superior a 30% ao dia deverá ser descartada.
Excesso de Carregamento
O carregamento a mais pode também ser prejudicial. As baterias devem ser
carregadas apenas o necessário, especialmente as baterias de NiMH. Um
carregamento de uma noite quando apenas algumas horas bastariam, pode
encurtar consideravelmente a vida de uma bateria. Segundo Jerry Wiles, da
Batteries Plus, «há mais baterias a falharem por excesso de carregamento do
que por abusos de outra ordem qualquer.
BATERIA DE CHUMBO

Inventada pelo francês Gaston Planté, em 1860, contém um determinado número
de celas ligadas em série, sendo capaz de gerar 6, 12 ou mais volts,
dependendo do número de celas usadas (aproximadamente 2 V por cela) em sua
construção. O ânodo, constituído de chumbo (Pb), e o cátodo, de óxido de
chumbo IV (PbO2),estão mergulhados em solução aquosa de ácido
sulfúrico (H2SO4) com densidade igual a 1,28 g/cm3.
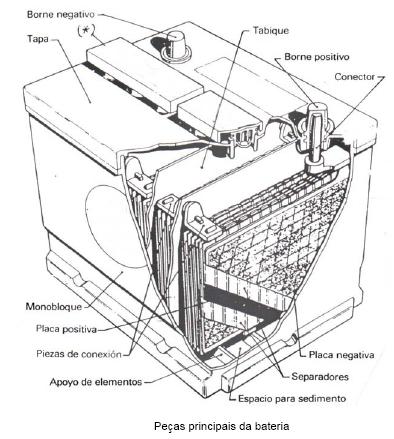
Durante o seu uso, ocorrem as seguintes semi-reações:
ÂNODO: Pb + SO42-
→
PbSO4 + 2e-
CÁTODO: PbO2 + SO42- + 4 H+ + 2e-
→
PbSO4 + 2 H2O
REAÇÃO GLOBAL: Pb + PbO2
+ 2 SO42-
+ 4 H+ → 2
PbSO4 + 2 H2O
À medida que a bateria funciona, o ácido sulfúrico vai sendo consumido e,
portanto, a densidade da solução diminui. Este fato possibilita o teste da
carga da bateria com o auxílio de um densímetro. Ligando-se a bateria a um
gerador de corrente elétrica contínua, podemos efetuar sua recarga. O
gerador movimenta a corrente elétrica em sentido contrário, e com isso todas
as reações que ocorrem são invertidas. Este é o papel do alternador
existente em um automóvel, que tem como função recarregar continuamente a
bateria.
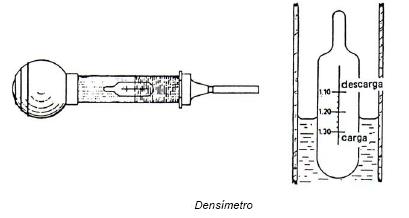
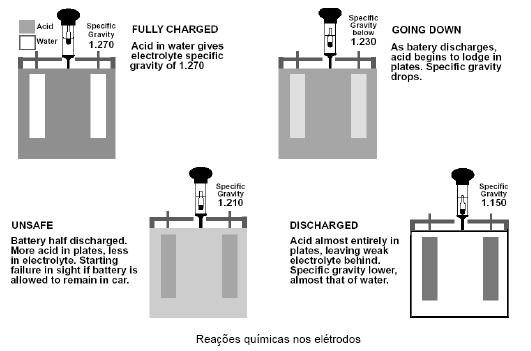
À medida que
a bateria descarrega, os íons de sulfato do ácido combinam-se com o chumbo e
o dióxido de chumbo das placas e a densidade do ácido (eletrólito) diminui
assim como a gravidade específica. Quando a bateria está carregada o
eletrólito tem uma gravidade específica de 1,270 (1,270Kg por litro), que
vai diminuindo até 1,150 que é o valor correspondente ao estado da bateria
completamente descarregada. O valor da gravidade específica pode ser medido
através de um densímetro.

Quando a
bateria está para se descarregar o enxofre que se encontra no ácido
sulfúrico, que constitui o eletrólito, separa-se e move-se até às placas,
tal fenômeno pode ser observado na figura a seguir.
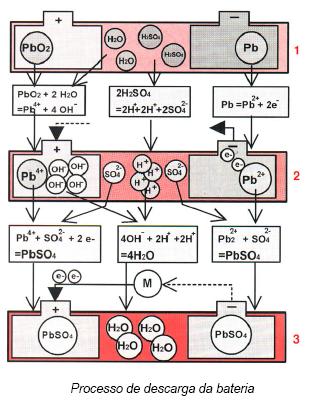
PROCESSO DE DESCARGA DA BATERIA
1ª FASE
O eletrólito, composto por água (H2O) e ácido sulfúrico (H2SO4)
dissocia-se. Parte das moléculas de água combinam-se com o peróxido de
chumbo da placa positiva para formar íons de chumbo com falta de elétrons
(Pb4+) e íons de hidróxido (OH−). Uma parte de ácido
sulfúrico decompõe-se em íons sulfato (SO42−) e íons
hidrogênio (H+)
2ª FASE
Assim que um circuito exterior à bateria ligue o eléctrodo negativo ao
positivo, o chumbo do eletrodo negativo cede dois elétrons aos íons de
chumbo do elétrodo positivo.
3ª FASE
Os elétrons provenientes da placa negativa permitem que, no eletrodo
positivo, o chumbo combine com o sulfato originário do eletrólito, formando
o sulfato de chumbo (PbSO4). Os íons de hidrogênio do eletrólito
combinam-se com os íons hidróxido (OH−) provenientes da placa
positiva, formando água (H2O). Á medida que estas reações
ocorrem, a diferença de potencial entre os eletrodos vai diminuindo. A força
eletromotriz e a densidade do eletrólito diminuem, uma vez que este último
perde o ácido sulfúrico.
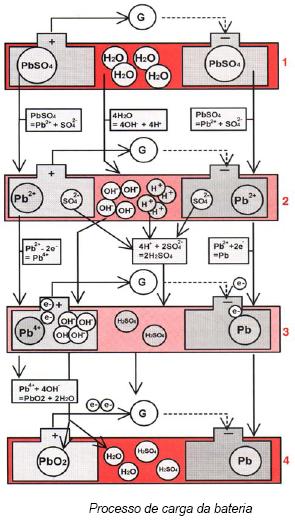
PROCESSO DE CARGA DA BATERIA
1ª FASE
O sulfato de chumbo (PbSO4) dos eletrodos, positivo e
negativo começa a dissociar-se em íons de chumbo (Pb2+) e em íons
de sulfato (SO42−). A água do eletrólito separa-se em
íons de hidrogênio (H+) e em íons de hidróxido (OH−).
2ª FASE
Os íons sulfato das placas combinam-se com o hidrogênio para formar o ácido
sulfúrico, os íons chumbo da placa positiva perdem dois elétrons para os
íons de chumbo da placa negativa.
3ª e 4ª FASE
Os hidróxidos do eletrólito combinam-se com os íons de chumbo da placa
positiva para formar o dióxido de chumbo e ceder a água ao eletrólito, assim
todos os elementos são reconstruídos e a bateria retorna à sua condição de
carga total.
Características: produzem elevada voltagem em pouco tempo e podem ser
recarregadas.
Utilização: automóveis, caminhões, tratores, aviões, aparelhos de
PABX, etc.
Vantagens:
custo relativamente baixo, resistência a grandes variações de temperatura e
grande durabilidade.
Desvantagens:
pesada, demora bastante tempo a ser carregada, descarrega-se rapidamente,
sofre uma diminuição (pequena, mas constante) de voltagem durante sua
utilização e não pode ser recarregada totalmente com tanta frequência como
os outros tipos. A sua melhor utilização é esporádica, uma vez que este tipo
de bateria é desenhado para ser constantemente carregada e eventualmente
descarregada (ex.: é o tipo utilizado em automóveis, sendo carregada com o
motor em funcionamento e descarrega nos arrancas ou no funcionamento de
dispositivos com o veiculo desligado.
BATERIA DE GEL OU SELADA

As baterias de Gel contêm um
aditivo de sílica que envolve o eletrólito. No gel, que envolve o
eletrólito, formam-se micro fendas que permitem as reações e recombinações
entre a placa positiva e a placa negativa. Estas baterias usam a tecnologia
VRLA (Valve Regulated Lead Acid Battery), ou seja, são seladas e possuem um
mecanismo de válvula de regulação que permite o escape dos gases, hidrogênio
e oxigênio, durante o processo de carga. A tensão de carga, neste tipo de
baterias, é mais baixa que nos outros tipos de baterias ácidas.
Vantagens - Não
têm evaporação eletrolítica, maior resistência a temperatura elevadas,
choque e vibração.
Desvantagens - Preço mais elevado do que as baterias de chumbo.
BATERIA AGM

As baterias AGM (Absorved Glass Mat), são o último passo
na evolução das baterias ácidas. Em vez de usarem gel, as AGM usam fibra de
vidro a envolver o eletrólito, o que contribui para que sejam as mais
resistentes aos impactos. Estas baterias também utilizam a tecnologia VRLA,
fazendo tudo o que as de Gel fazem mas melhor.
RESUMINDO TEMOS....

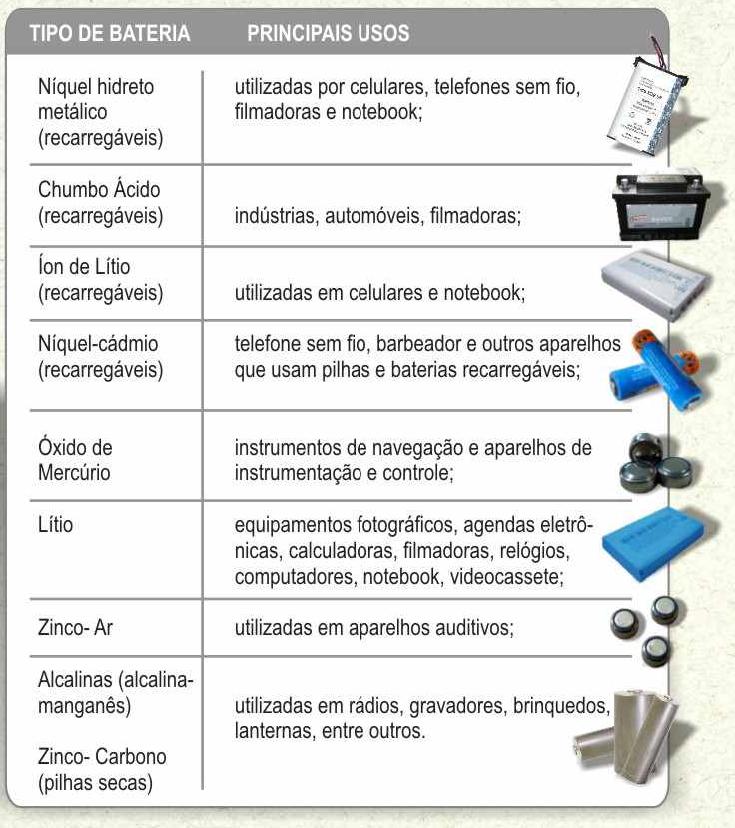
PILHAS
FALSAS

Com
o uso crescente de pilhas recarregáveis, a indústria pirata não se limitou a
falsificar pilhas convencionais. Dependendo do lugar, é muito mais fácil
achar baterias falsas do que verdadeiras. O motivo de tamanha distribuição é
a oferta por um preço bem mais em conta.
As
pilhas falsificadas - sejam elas convencionais ou recarregáveis - podem
trazer transtornos.
Esse
tipo de pilha deve ser evitado, entre outros, pelos seguintes motivos:
•
Frequentemente possui menos capacidade do que informa a embalagem;
•
Utiliza tecnologia inferior à anunciada, por exemplo, NiCd ao invés de NiMH;
•
Pode ter qualidade inferior e vazar mais facilmente;
•
Utiliza uma quantidade metais pesados muito maior do que o permitido por
lei;
•
Pode possuir tempo de vida útil mais curto que o normal.
Os
falsificadores de pilhas se mostram muito habilidosos nessa “arte”. Mesmo
assim, é possível descobrir quando uma pilha é falsa observando uma série de
características.

Por
exemplo, é comum piratas anunciarem que uma pilha AA tem 3600 mAh quando, na
verdade, o máximo que já se conseguiu é 2600 mAh.
Por
isso, é recomendável comprar pilhas em lojas ou sites renomados.
Na
dúvida, você pode entrar em contato com um fabricante ou distribuidor
oficial para saber quais estabelecimentos ou sites vendem o produto.
Pode
ser um pouco mais caro adquirir o original, mas ao menos você não estará
comprando “gato por lebre”.
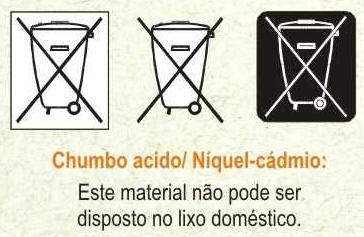
DESCARTE
As
pilhas e baterias, quando descartadas em lixões ou aterros sanitários,
liberam componentes tóxicos que contaminam o solo, os cursos d'água e os
lençóis freáticos, afetando a flora e a fauna das regiões circunvizinhas e o
homem, pela cadeia alimentar.
Devido
a seus componentes tóxicos, as pilhas podem também afetar a qualidade do
produto obtido na compostagem de lixo orgânico. Além disso, sua queima em
incineradores também não consiste em uma boa prática, pois seus resíduos
tóxicos permanecem nas cinzas e parte deles pode volatilizar, contaminando a
atmosfera.
Os
componentes tóxicos encontrados nas pilhas são: cádmio, chumbo
e mercúrio. Todos afetam o sistema nervoso central, o fígado, os rins
e os pulmões, pois eles são bioacumulativos.
Considerando os impactos negativos causados ao meio ambiente pelo descarte
inadequado das pilhas e baterias usadas e a necessidade de disciplinar o
descarte e o gerenciamento ambientalmente adequado (coleta, reutilização,
reciclagem, tratamento ou disposição final) de pilhas e baterias usadas, a
Resolução n° 257/99 do CONAMA resolve em seu artigo primeiro:
"As pilhas e baterias que contenham em suas composições chumbo, cádmio,
mercúrio e seus compostos, necessário ao funcionamento de quaisquer tipos de
aparelhos, veículos ou sistemas, móveis ou fixos, bem como os produtos
eletroeletrônicos que os contenham integrados em sua estrutura de forma não
substituível, após seu esgotamento energético, serão entregues pelos
usuários aos estabelecimentos que as comercializam ou à rede de assistência
técnica autorizada pelas respectivas indústrias, para repasse aos
fabricantes ou importadores, para que estes adotem diretamente, ou por meio
de terceiros, os procedimentos de reutilização, reciclagem, tratamento ou
disposição final ambientalmente adequado".
Os
processos de reciclagem de pilhas e baterias podem seguir três linhas
distintas: a baseada em operações de tratamento de minérios, a
hidrometalúrgica ou a pirometalúrgica. Algumas vezes estes processos são
específicos para reciclagem de pilhas, outras vezes as pilhas são recicladas
juntamente com outros tipos de materiais. Alguns desses processos estão
mencionados a seguir:
Fontes: Agency for
Toxic Substances and Disease Registry - ASTDR (2002); United States
Protection Agency - USEPA (2002); World Health Organization - WHO (2002).
* Esses metais estão incluídos na Lista "TOP 20"
da USEPA, entre as 20 substâncias mais perigosas à saúde e ao ambiente: Cd,
Cr, Hg, Pb (Comprehensive Environmental Response, Compensation and Liability
Act- CERCLA 2002).
** Agente Teratogênico é definido como qualquer
substância, organismo, agente físico ou estado de deficiência que, estando
presente na vida embrionária ou fetal, produz uma alteração na estrutura ou
função da descendência.
***As pilhas analisadas não demonstraram apresentar riscos à saúde do
consumidor, mas é importante estar atento para o seu descarte, pois este
pode ser danoso ao meio ambiente, se realizado de maneira inadequada.
PRINCIPAIS DÚVIDAS SOBRE PILHAS E BATERIAS
O que é
mAh?
O mAh é a medida de
capacidade de energia das pilhas e significa “miliámperes por hora”. Assim,
para saber a quantidade de tempo que uma pilha pode durar, é preciso apenas
verificar no produto o consumo de energia, indicado em mAh.
Quantas
vezes a pilha recarregável pode ser recarregada?
Dependendo da forma
como for utilizada, sua duração será extremamente alta. Se utilizada
corretamente, recarregando somente quando a bateria estiver 100%
descarregada, mais longa será a vida da pilha. Já o seu uso irregular
resulta em uma vida mais curta. Por isso, é impossível dizer ao certo quanto
dura uma pilha recarregável. De qualquer forma, uma pilha recarregável,
sendo utilizada da forma correta ou não, teria a capacidade para ser
recarregada, no mínimo, centenas de ve.
Autonomia
Ao comprar uma
bateria a principal dúvida que surge é em relação à sua autonomia. É comum
encontrarmos uma mesma bateria com informações diferentes sobre seu tempo de
conversação e de espera (stand-by). Isto ocorre porque sua duração depende
de diversos fatores que impossibilitam a especificação de sua autonomia pelo
tempo. O tempo de fala e espera são influenciados por fatores como volume da
campainha e do fone, ativação ou não do sistema de vibração (vibra-call),
sistema utilizado pelo aparelho (CDMA, TDMA ou Analógico), intensidade do
sinal no local entre outros. Por isso, a melhor maneira de diferenciar as
mesmas é olhando para sua capacidade de carga (mAh).
Capacidade de Carga
As baterias menores
costumam ter uma capacidade de carga em torno de 500 mAh e as de maior
capacidade estão em torno de 1000 mAh. Existem também baterias com
capacidade extra que podem chegar aos 2000 mAh, mas estas tornam o aparelho
significativamente mais pesado. Logicamente, quanto maior for a capacidade
de carga, maior será o tamanho da bateria. Em relação ao tamanho e peso, as
baterias de Li-Ion levam vantagem pois são menores e mais leves que as de
Ni-MH com mesma capacidade de carga. Quando sua necessidade for a maior
autonomia possível para o aparelho, dê preferência para as baterias de
Li-Ion de maior capacidade disponíveis. A capacidade de carga deve ser
informada na etiqueta da bateria ou pelo fabricante da mesma.
Qual
é o tempo de vida útil da minha bateria?
As baterias têm uma
vida útil aproximada de 300 ciclos de recarga, variando conforme as
condições de recarga, temperatura, cuidados de preservação, etc. Para
descarregar uma bateria, utilize acessórios apropriados como as bases
carregadoras com opção para descarga ou, deixe a mesma no aparelho até ele
"apagar".
As baterias são a
"alma" do celular e as de maior tempo de stand-by (espera) e talk-time(conversação)
são as de tarja azul (Lítio-Ion).
Considera-se como
stand-by quando o telefone celular permanece ligado, passível de receber ou
realizar chamadas.
Considera-se como
talk-time quando o telefone celular está sendo utilizado em conversação. O
tempo de recarga para as baterias depende do tipo de carregador utilizado e
do tipo de bateria utilizada. Normalmente o manual que acompanha o aparelho
informa o tempo necessário para recarga. Alguns modelos de celular consomem
mais energia, sendo portanto interessante que o comprador verifique antes de
comprar qual o que mais lhe interessa, considerando não só as
características de estética e peso, como também em função das demais
facilidades de uso que o aparelho oferece (capacidade de rediscagem
automática, etc.)
Como
aumentar a capacidade e a vida útil de minha bateria?
Para que sua nova
bateria alcance a capacidade máxima de carga, deverá permanecer no
carregador durante 20 horas nas 3 primeiras cargas, esperando que a mesma se
descarregue por completo antes da carga seguinte. Não utilize carregadores
rápidos (carregador automotivo e carregador de viagem) nestas primeiras
cargas e posteriormente utilize-os somente quando necessários, uma vez que
estes reduzem a vida útil das baterias.
Caso você só possua
este tipo de carregador reduza o tempo das cargas iniciais para 6 horas. As
baterias de Níquel-Metal (Ni-MH) perdem sua capacidade de carga mais rápido
com a continuidade de suas recargas ("efeito memória"). Para minimizar esta
perda, descarregue completamente estas baterias uma vez por semana. As
baterias de Lítion-Ion (Li-Ion) não possuem "efeito memória" e por isso suas
descargas podem ser feitas com menor frequencia (mensalmente). Outra
vantagem das baterias de Li-Ion (também conhecidas como "tarja azul") é o
fato de serem mais leves que as de Ni-MH (também conhecidas como "tarja
verde").
O
que acontece se eu deixar a bateria por muito tempo no recarregador?
O excesso de carga
diminui a vida útil da bateria e pode causar o aquecimento da mesma.
Que
tipos de bateria de telefones celulares existem hoje no mercado?
São três modelos:
níquel-cádmio, usado em aparelhos analógicos; níquel-metal-hidreto; e
lítio-íon.
Estes dois últimos são utilizados pelos celulares da geração digital.
Qual
a próxima geração de baterias?
Os modelos mais
novos são feitos com polímeros. Eles apresentam um gel em sua composição
química. São menores que os modelos de lítio-íon e duram mais tempo.
Todas as baterias de telefones celulares são afetadas pelo "efeito memória"?
Não. Os únicos
modelos que podem sofrer este tipo de efeito são os fabricados com o
composto químico de níquel-cádmio. Estas baterias são usadas nos modelos de
celulares analógicos.
Como o sistema de
recarga delas não é inteligente, a bateria deve ser zerada antes de ser
plugada ao carregador. Isso acontece porque, neste caso, o carregador não
consegue entender que deve completar a capacidade de carga da bateria,
independentemente do resíduo que restar.
Os modelos de
bateria que acompanham os celulares da geração digital não sofrem esse
efeito. Neste time, estão as baterias lítio-íon e níquel-metal-hidreto.
Se
as baterias de telefones digitais não são afetadas pelo "efeito memória",
por que os fabricantes recomendam zerá-las antes de um novo processo de
recarga?
A vida útil de uma
bateria é composta por um número limitado de ciclos de carga. As baterias
saem de fábrica programadas para durar, em média, 500 ciclos, o que equivale
a dois anos de uso, sendo que alguns modelos podem chegar a 36 meses de
utilização. Por isso, toda vez que a bateria é conectada ao carregador, um
ciclo está sendo eliminado. Por esta razão, os fabricantes não aconselham
que a bateria seja recarregada diariamente.
O ideal é esperar a
carga terminar completamente para que se inicie um novo processo.
Como
o usuário deve carregar a bateria pela primeira vez?
Os fabricantes
comentam que, quando um celular é vendido, os funcionários da loja costumam
dar uma carga mínima na bateria. Esta quantidade é suficiente para que o
aparelho seja programado de acordo com os parâmetros da operadora de
telefonia celular. Ao chegar em casa, o usuário deve esperar até que a carga
seja totalmente zerada. Quando o aparelho deixar de funcionar, a bateria
deve ser recarregada por 24 horas seguidas. A partir daí, ele poderá usá-la
normalmente. Pode, inclusive, recarregá-la todos os dias, mas assim estará
esgotando mais rápido os limitados ciclos da bateria.
Além de seguir as
recomendações referentes aos procedimentos de carga e descarga, que outros
cuidados devem ser tomados para prolongar a vida útil das baterias de
telefones celulares?
Um das primeiras
advertências dos fabricantes para os donos de telefones celulares diz
respeito à procedência dos periféricos que acompanham o telefone. Este time
inclui baterias e carregadores.
O ideal, na opinião
dos fabricantes, é que se comprem produtos originais e se evitem os
compatíveis, isto é, aqueles produzidos por outras empresas. As baterias são
ainda alvo de falsificadores.
De acordo com os
fabricantes, a falsificação é comum, e induz o usuário a achar que a bateria
apresenta a mesma composição química do modelo original. Outra recomendação
é cuidar para que as baterias e os carregadores não fiquem expostos
excessivamente ao calor. Deve-se ter atenção também aos tombos.
Formadas por
circuitos sensíveis, as baterias não são muito resistentes a quedas. Também
é preciso evitar o contato manual com as lâminas de cobre expostas
externamente nas baterias.
O contato dos dedos com estas lâminas acaba provocando a oxidação delas.
Por
que o preço dos aparelhos celulares baixa a cada ano e o das baterias não
diminui?
A justificativa dos
fabricantes para os valores altos está baseada no desenvolvimento
tecnológico.
Eles afirmam que o
processo de elaboração das baterias requer muita pesquisa em tecnologia,
além de envolver o uso de matéria-prima nobre. Outra explicação para o alto
custo das baterias se refere à quantidade de funções que elas vêm
desempenhando. Enquanto a função dos modelos analógicos se restringia ao
fornecimento de energia, as baterias dos telefones digitais estão agregando
funções, como a de módulo de vibração.
Todas as baterias de celulares causam danos ao meio ambiente ao serem
jogadas no lixo?
Não. As únicas
baterias de celulares que devem ser recolhidas por um programa específico de
reciclagem são as de níquel-cádmio. O motivo é que o cádmio, assim como o
mercúrio e o chumbo, é considerado um metal potencialmente nocivo ao
meio-ambiente. Os demais modelos podem ser eliminados com o lixo doméstico.
Os fabricantes recomendam, inclusive, que não se armazene pilhas e baterias
sem metais nocivos em casa.
Mesmo depois de
usadas, essas unidades podem deixar escapar compostos químicos que
causam danos quando entram em contato com mucosas.
Porque uma bateria de automóvel (chumbo) dura tanto tempo?
Em uso contínuo, a
bateria de chumbo duraria poucas horas, mas no automóvel, ela é recarregada
pelo gerador, através da aplicação de uma diferença de potencial superior a
da bateria em sentido contrário (eletrólise).
É correto colocar água na bateria de chumbo?
As constantes recargas
efetuadas pelo gerador na bateria de chumbo, causa também a decomposição da
água da solução da bateria, por isso, periodicamente coloca-se água
destilada, no entanto, atualmente estão sendo comercializadas baterias
seladas, que em princípio não necessitariam da adição de água.
Quando a bateria de chumbo fica totalmente descarregada?
Durante a descarga da
bateria o ácido sulfúrico é consumido, com isso a concentração e a densidade
da diminuem gradativamente. Quando a densidade atinge valores inferiores a
1,20g/mL, a bateria está praticamente descarregada. Por isso pode-se testar
a carga da bateria com um densímetro.
Depois que a pilha comum para de funcionar (descarrega) ela
pode ser recarregada e voltar a funcionar novamente?
Não. Porque a pilha de
Leclanché não é recarregável (semi-reação de redução irreversível). A pilha
cessa seu funcionamento quando todo o dióxido de manganês é consumido.
Será que a pilha comum dura mais se intercalar períodos de
uso e de repouso?
Sim. Pois ao utilizar
continuamente a pilha, os gases formados: hidrogênio e gás amônia impedem o
fluxo de cargas elétricas fazendo com que a corrente caia. Retirando a pilha
do aparelho, após um certo tempo ela irá funcionar, pois as bolhas gasosas
formadas serão desfeitas
Se colocarmos uma pilha gasta na geladeira ela é recarregada?
Não, ela volta a
funcionar durante algum tempo, porque a baixa temperatura faz com que o gás
amônia seja removido, o que não significa que ela foi recarregada.
E na água quente a pilha é recarregada?
Recarregada não, mas o
aumento de temperatura irá favorecer a perda de elétrons, fazendo com que
ela funcione por mais algum tempo.
Por
que será que as pilhas alcalinas duram mais que as comuns?
Nas pilhas alcalinas, o
meio básico faz com que o eletrodo de zinco sofra um desgaste mais lento,
comparado com as pilhas comuns que possuem um caráter ácido.
Home | Grafeno | Hidratos de Carbono | LHC | Bactéria GFAJ | Sperbactérias KCP | Como as cinzas prejudicam os aviões | Ônibus a Hidrogênio | Superátomos | O que os Faraós Bebiam | Metal Orgânico | Microondas no Laboratório de Química | Pré-Sal | Elementos Pseudo-metálicos | Crise Nuclear na Coreia | Crédito de Carbono | Reforma Ortográfica | Gripe Suína | Água Seca | Balança mais sensível do mundo | Chuva Seca | Adoçantes Artificiais | Estato Gasoso | Por que a água sanitária desinfeta | Adrenalina | Água | Antibióticos | Ácido Desoxirribonucleico | Armas Químicas | Armas Biológicas | Armas Nucleares | Bafômetro | Bicabonato de Sódio | Biodiesel | Bronzeamento Artificial | Bioquímica das Células | Botulismo | Cálculos em Química por Análise Dimensional | Células Tronco | Clonagem | Colesterol | Combustíveis | Ciclos Biogeoquímicos | Cristais Líquidos | Curiosidades_químicas.htm | Desodorantes | Etanol | Fenilcetonúria | Química do Vagalume | Neuroquímica | Vida | Ecstasy | Moléculas que matam | Coca Cola Diet x Bala Mentos | Química do Beijo | Novo Tipo Ligação Química | Datação do C 14 | Bioquímica da Arteriosclerose | Equilíbrio Ácido Base no Sangue | Sabão Molécula Intrigante | Cafeína | Vírus | Feromônios | Benzeno | Corantes | Nicotina | Polônio | Leptina | Raio X | Polímeros: A era dos plásticos | Vacinas Comestíveis | Química Combinatória | Gás Hélio | Sangue Artificial | Química do Cabelo | Elementos Químicos | Química Medicinal | Explosivo C4 | THC | Notícias Quânticas | Forças Intemoleculares | Gás Carbônico | Biotecnologia | Química das Aranhas | Vitaminas | Moléculas Quirais | Carboidratos | Colesterol II | Lipídios | Proteínas | Química do Sorvete | Química do Vinho | Química na Cozinha | Quimioterapia | Dicionário de Química | Diet ou Light? | Fique Por Dentro | Química das Aranhas | Gráficos | Grandes Nomes da Ciência | Histórico da Química | Lâmpadas Fluorescentes | Meio Ambiente | Mol | Os Segredos da Mumificação | Perguntas Superinteressantes | Química do Cigarro | Química do Cotidiano | Tratamento da Água | Salmonella | Pilhas e Baterias | Polímeros Condutores de Eletricidade | Umidade Relativa do Ar | Viagra | Vitaminas e Minerais
Este site foi atualizado em
04/03/19