PROFESSOR
PAULO CESAR
|
PROFESSOR PAULO CESAR |
|
|
|
|
|
Módulo ILigação química em compostos iônicosAula 1: Ligação química, estrutura cristalina e energia reticular de compostos iônicosMeta
Objetivos
Índice 1. Definições e propriedades dos compostos iônicos 2. Ligação química e estrutura dos cristais iônicos2.1. Ligação iônica2.2. Estrutura dos retículos cristalinos iônicos 3. Energia reticular. Ciclo de Born-Haber 4. Solubilidade das substâncias iônicas
1. Definições e propriedades dos compostos iônicosAs ligações químicas são interações entre átomos ou íons e estão intimamente relacionadas às configurações eletrônicas dessas espécies. O que ocorre quando dois átomos ou íons se aproximam? Uma ligação química é estabelecida entre as espécies apenas se o arranjo final de seus núcleos e de seus elétrons conferir ao par uma energia potencial menor que a soma das energias dos átomos ou íons isolados. Em outras palavras: podemos dizer que um composto químico é formado apenas se proporcionar uma situação de estabilidade termodinâmica maior que aquela envolvendo seus constituintes isoladamente. Assim, podemos dizer que quando uma ligação química é formada, energia é liberada! Existem três mecanismos possíveis para alcançar, via formação de ligações químicas, uma situação termodinamicamente mais estável que aquela de átomos ou íons isolados. A ligação iônica é estabelecida pela atração eletrostática entre íons de cargas opostas [cátions (íons positivamente carregados) e ânions (íons negativos)], que se arranjam no retículo cristalino de maneira a aumentar as forças atrativas (entre cargas opostas) e diminuir as repulsivas (entre cargas iguais). Ou seja, a posição relativa (distância interiônica média) de cátions e ânions num cristal iônico é o resultando principalmente do balanço de forças eletrostáticas. A ligação covalente é caracterizada pelo compartilhamento de um par de elétrons entre dois átomos vizinhos que, unidos, podem formar moléculas ou sólidos covalentes (diamante e da sílica são exemplos de sólidos covalentes). E a ligação metálica, como o próprio nome diz, é responsável por manter metais unidos através do que podemos chamar de “mar de elétrons”, que funciona como uma “cola negativamente carregada”, ligando os cátions metálicos. A manifestação de cada um desses tipos de ligação química depende exclusivamente da configuração eletrônica dos elementos, ou seja, da natureza dos átomos. Pelo que você viu até aqui, o único dos três tipos de ligação química mencionados que aparentemente não tem natureza eletrostática tão pronunciada é a ligação covalente. Cada tipo de ligação química pode levar a substâncias com propriedades físicas e químicas bem distintas. Substâncias iônicas, como o sal de cozinha (NaCl), normalmente apresentam alto ponto de fusão (p.f.) e dureza (embora possam ser frágeis, quebradiças), alta solubilidade em água (e em outros solventes polares com alta constante dielétrica) e baixa condutividade iônica no estado sólido, mas alta condutividade em solução. Metais típicos exibem alta condutividade térmica e elétrica, densidade elevada e brilho metálico. As moléculas diferem muito entre si em termos de estruturas e propriedades, de maneira que as generalizações são bem mais limitadas. Sólidos covalentes, por sua vez, são normalmente maus condutores elétricos e insolúveis em água.
Salitre (nitrato de sódio e potássio) no deserto do Atacama (Chile).
Cobre (substância metálica).
Açúcar (moléculas de sacarose, C12H22O11). Ligue-se!Você sabia que os sólidos podem ser classificados de acordo com o tipo de ligação química predominante em sua estrutura?
Zeólita tipo faujasita
Fulereno.
Cristal de quartzo (sílica mais estável).
Diamante (a) e grafita (b). Você pode observar na Tabela 1 algumas propriedades de sais, metais, sólidos moleculares e covalentes.
O diamante pode ser convertido em grafita em alta temperatura e pressão. O inverso também pode ocorrer. Veja o diagrama de fase do carbono visitando os sites:
2. Ligação química e estrutura dos cristais iônicos2.1. Ligação iônicaOs compostos iônicos podem ser formados por duas rotas distintas: (a) Reação de metátese (comumente chamada de dupla troca): Ex.: Ba(NO3)2(aq) + Na2SO4(aq) ® BaSO4(s) + 2 NaNO3(aq) (b) Reação heterogênea: Ex.: K(s) + ½ Cl2(g) ® KCl(s) Em ambos os casos, cátions e ânions, quando formados, aproximam-se para formar o sal. A natureza da ligação iônica é essencialmente eletrostática. Cátions e ânions são atraídos eletrostaticamente e os íons de mesma carga são repelidos. O balanço das forças de atração e repulsão define a disposição final dos íons no retículo cristalino e, conseqüentemente, as distâncias interiônicas. Relembre as expressões matemáticas para a
força de atração eletrostática ( onde r é a distância entre as
cargas (q) (ou íons) e 1/4πε
é uma constante. Para a situação de repulsão eletrostática,
na qual teríamos Como a energia é uma propriedade escalar, se as cargas forem opostas (sinais trocados), a energia é negativa; logo, Eatr < 0; mas se as cargas forem iguais (mesmos sinais) (++ ou --), a energia é positiva, isto é, Erep > 0. Bem... Aqui surge uma questão importante que precisa ser esclarecida! Qual a relação entre energia eletrostática, distância entre os íons e estrutura do cristal iônico? Como você já estudou, para que um composto iônico seja formado, o arranjo final de seus íons precisa configurar uma situação de menor energia (maior estabilidade) que aquela para os íons isolados. Se considerarmos que a energia potencial total do composto salino é dada pela soma Eatr + Erep, quanto mais próximos estiverem os íons de cargas opostas e mais distantes estiverem os íons de mesma carga, menor será a energia total. Como?! É simples: para cátions bem próximos de ânions, temos um valor pequeno de r (chamado aqui de distância interiônica) na equação para Eatr (veja acima), fazendo com que o valor da energia de atração seja mais negativo (mais positivo em módulo). Para o caso da repulsão, quanto maior for a distância cátion-cátion ou ânion-ânion, menor (menos positivo) será o valor de Erep. Assim, temos uma situação de menor energia. É comum imaginar que, na formação do sólido iônico, os íons vão se aproximando e se arranjando de maneira a minimizar a energia de atração e de repulsão. Na formação de um retículo iônico, é possível
pensar que, quando o primeiro par iônico [M+X-]
é gerado, o campo elétrico atrativo (para o campo gerado por q+
atuando sobre q- a uma distância r:
Normalmente se pensa que o crescimento de um retículo iônico ocorre de maneira anisotrópica, ou seja, sem direcionamento no espaço. Pensa-se assim porque o campo elétrico gerado pelos íons não tem orientação espacial. Com isso, a ligação iônica seria igual em todas as direções do espaço. O único critério estrutural que íons devem adotar é que as distâncias interiônicas favoreçam a atração e desfavoreçam a repulsão. Por essas razões, a ligação iônica é dita não-direcional. Você concorda? Dê uma olhada na seção 2.2 e tire suas próprias conclusões. Examinando a natureza dos elementos formadores das substâncias iônicas e dos íons originados por eles, algumas particularidades se evidenciam:
Após a análise desses fatos e considerando a pronunciada inércia química dos gases nobres, que apresentam oito elétrons em seu último nível de energia (exceto o hélio, que tem dois elétrons), Walter Kossel, em 1916, formulou uma nova teoria. Kossel admitiu que os elementos seriam quimicamente ativos por terem, em seu último nível de energia, um número de elétrons menor que oito. Por esse motivo, tais elementos tenderiam a ajustar o número de elétrons nos seus níveis exteriores, capturando-os ou cedendo-os.
Prof. Walter Kossel (1888-1956) As idéias de Kossel originaram a teoria da eletrovalência, que passou a ser incorporada no modelo ou regra do octeto (discutido com mais detalhe nas próximas aulas). Para atingir a estabilidade, segundo o modelo do octeto, os átomos dos metais representativos (grupos 1 e 2) perdem seus elétrons de valência, transformando-se em cátions, e os átomos dos não-metais (grupos 16 e 17) recebem elétrons e formam ânions. Em outras palavras, podemos dizer que a facilidade dos metais em perder elétrons se traduz em potenciais de ionização (1o P.I.s) relativamente baixos (menores que 800 kJ/mol, enquanto para não-metais é sempre maior que 1,0 MJ/mol). Conseqüentemente, as afinidades eletrônicas (1a A.E.s) dos não-metais são sempre bem maiores que aquelas para os alcalinos e alcalinos terrosos. Para que esse conjunto de íons permaneça coeso, as partículas iônicas de cargas contrárias se atraem e se mantêm atraídas ao máximo, ao passo que a repulsão deve permanecer tão baixa quanto possível. O resultado imediato dessas interações é que o conjunto de íons deve ser extremamente organizado e estável, de forma a estabelecer o melhor compromisso entre a atração e a repulsão.
2.2. Estrutura dos retículos cristalinos iônicosUma boa aproximação para estimar o tipo de estrutura cristalina de um composto iônico se dá ao conhecer os raios iônicos dos íons. Quanto maiores as distâncias internucleares r, maiores os raios iônicos. A Tabela 2 mostra alguns valores de raios iônicos determinados experimentalmente e valores de números de coordenação (N.C.s) para os íons. N.C. é uma quantidade importante e significa o número de vizinhos mais próximos ligados a um íon central. É interessante observar que o raio iônico efetivo aumenta com o aumento do N.C. para um determinado íon. Para cátions e ânions, como o N.C. aumenta, a repulsão entre os contra-íons (íons de mesma carga, mas oposta àquela do íon central) aumenta (tem mais íons de mesma carga próximos de um único íon de carga oposta), fazendo com que os raios iônicos aumentem, ou seja, as distâncias interiônicas cátion-ânion aumentem. Isso deve se refletir numa menor estabilidade do retículo. Alternativamente, para um N.C. baixo, os contra-íons têm mais facilidade de se aproximar do íon central, ocasionando uma diminuição de r e, conseqüentemente, dos raios iônicos. É importante mencionar que os N.C.s também são obtidos experimentalmente.
Na Tabela 2, você pode facilmente perceber que o raio catiônico é sempre menor que o aniônico para dois elementos num mesmo período (veja os casos dos íons Na+ e Cl- ou K+ e Br-, por exemplo). É importante relembrar que os valores dos raios iônicos dependem da estrutura (do número de coordenação), e não o inverso. A Figura 1 mostra o retículo cristalino do cloreto de sódio (NaCl) determinado experimentalmente. É possível observar que cada íon cloreto está circundado por seis íons Na+ e cada íon sódio está ligado a seis íons cloreto. Assim, ambos os íons têm N.C. = 6. A estequimetria do cristal é 1:1 (composto do tipo MX). Chamamos a estrutura cristalina do NaCl de cúbica de face centrada. A estrutura cristalina e todos os parâmetros geométricos (distâncias internucleares e ângulos interiônicos) são determinados experimentalmente por uma técnica chamada difração de raios X.
Figura 1. Estrutura cristalina do NaCl. A estrutura cristalina do cloreto de césio (CsCl) é do tipo cúbica de corpo centrado (Figura 2). No CsCl, o N.C. do cloreto é igual a oito, assim como é o do césio (é só imaginar que cada vértice de um cubo na verdade faz simultaneamente parte de oito cubos ligados). Na estrutura do NaCl, cada íon está no centro de um octaedro, ou seja, tem geometria octaédrica. No CsCl, cada íon tem geometria cúbica.
Figura 2. Comparação entre as estruturas do NaCl e CsCl.
O sulfeto de zinco (ZnS) também é um considerado um composto iônico do tipo MX, embora muitos o considerem um composto com características de sólido covalente (eu diria que está no meio do caminho!). Ele apresenta dimorfismo, ou seja, pode cristalizar sob a forma de dois retículos distintos: (a) wurtzita hexagonal e (b) blenda de zinco cúbica (esfarelita). Em ambos os casos, o N.C. do Zn e do S é igual a quatro, e os dois apresentam geometria tetraédrica. Veja na Figura 3. Só por curiosidade: muitas televisões têm blenda de zinco em seus tubos de imagem.
Wurtzita hexagonal
Figura 3. Formas cristalinas do sulfeto de zinco.
Por curiosidade, veja nas fotos abaixo os minerais wurtzita e esfarelita (blenda de zinco).
Wurtzita com quartzo e fluoroapatita
Esfarelita com um cristal de quartzo
Dependendo da razão entre os raios iônicos de cátions (M+) e ânions (X-), rM/rX (ou rX/rM se rM>rX), é possível ter uma idéia da estrutura cristalina para sais do tipo MX. Veja a seguir:
Por exemplo, no LiCl, independentemente do valor de rLi usado (veja na Tabela 2), o valor de rLi/rCl fica entre 0,44 e 0,63. Ou seja, LiCl tem a estrutura do NaCl. No CsI, rCs/rI = 0,88 ou 0,91 (dependendo do rCs usado). Neste caso, a estrutura é do tipo CsCl. Faça um exercício: calcule a razão rM/rX para todos os haletos de metais alcalinos e faça uma previsão do tipo de estrutura dos sais. Para compostos iônicos do tipo MX2 (como CaF2, BaCl2, SnO2), pode ser feita uma análise análoga à que acabamos de fazer para MX. Nesse caso, as estruturas são do tipo fluorita (CaF2) ou rutilo (TiO2). Dê uma olhada na Figura 4. Como foi ressaltado no caso do sulfeto de zinco, a estrutura do rutilo lembra bastante a de um sólido covalente usual. Mas, mesmo assim, podemos considerá-la como sendo iônica. De uma maneira geral, é possível destacar que óxidos, sulfetos, nitretos de metais de transição formam compostos com alto caráter covalente. O que isto quer dizer? Isto quer dizer que os materiais formados muitas vezes exibem propriedades de sólidos covalentes, tais como insolubilidade em água e baixa condutividade iônica quando fundidos.
Fluorita (N.C. Ca2+ = 8 e N.C. F- = 4)
Rutilo (TiO2) (N.C. Ti4+ = 6 e N.C. O2- = 3) Figura 4. Fluorita e rutilo (MX2).
As seguintes generalizações podem ser feitas para compostos do tipo MX2:
Também podemos ter estruturas do tipo "antifluorita". É o caso, por exemplo, dos óxidos de metais alcalinos: Li2O,..., Rb2O. Nesses casos, o N.C. do cátion é quatro e do ânion é oito. Por curiosidade, veja nas fotos abaixo os minerais fluorita e rutilo.
Fluorita
Cristais amarelos de rutilo crescidos em hematita (Fe2O3).
Questões para você pensar! Voltamos agora a dar uma olhada na questão da não-direcionalidade das ligações iônicas. Você viu que, para um determinado número de coordenação, é possível definir um poliedro, chamado poliedro de coordenação. Assim, no cloreto de sódio, ambos os íons têm N.C. = 6 e apresentam geometria octaédrica no estado sólido. No caso das estruturas do tipo fluorita, o metal tem N.C. = 8 (geometria cúbica) e o ânion, N.C. = 4 (geometria tetraédrica). Por que normalmente um poliedro é preferencialmente associado a cada número de coordenação? Quero dizer, por exemplo, para N.C. = 6, por que a maior parte das estruturas é octaédrica e não trigonal prismática? Ambos os poliedros têm seis vértices, não têm?! Para N.C. = 4, a preferência é por um tetraedro, e não por uma geometria quadrática. Para N.C. = 3, é rara a geometria piramidal, e a preferência é pela trigonal plana. Será que essas preferências têm uma razão apenas eletrostática ou existe algum tipo de direcionalidade? Se houver algum caráter direcional, de onde ele vem? Sabemos que a principal característica da ligação covalente é o seu caráter direcional (você verá isso um pouco mais à frente). Então, será que as ligações iônicas exibem algum caráter covalente? Leia também sobre as regras de Fajans.  Regras de FajansAlguns aspectos importantesFuga do caráter iônicoCovalência parcial resulta em maior energia da ligação iônica. Regras de Fajans:
Reflita sobre estas questões; discuta-as no nosso FÓRUM. ATIVIDADE I1. Considere os raios iônicos abaixo [1pm = 10-12m]: Mg2+ (rMg = 86 pm) F- (rF = 119 pm) O2- (rO = 126 ppm) Calcule a razão rM/rX e estime o tipo de estrutura para os compostos iônicos MgO e MgF2. Faça uma pesquisa para confirmar sua estimativa. Qual o número de coordenação de cada íon em ambos os compostos?
3. Energia reticular. Ciclo de Born-HaberQual a energia de uma ligação iônica? Para os compostos iônicos, a quantidade chamada de energia do retículo cristalino, ou energia reticular, é uma medida da energia da ligação iônica. Existem duas definições para a energia reticular: A IUPAC (International Union of Pure and Applied Chemistry) não faz qualquer menção acerca da definição de energia reticular. Uma definição considera a energia reticular como a energia necessária para separar, a uma distância infinita, os íons, como íons em fase gasosa, de 1 mol de um composto iônico. Seria um valor positivo de energia e corresponderia a uma espécie de energia de quebra (ou dissociação) do retículo. A outra definição, que é adotada nesta disciplina, é a seguinte: energia reticular, ΔEret, é a energia associada ao processo de formação de 1 mol de um composto iônico sólido a partir da combinação de seus íons em fase gasosa. Nesta definição, o valor de energia reticular é negativo. Nas duas definições, o valor numérico da energia de retículo é o mesmo, só muda o seu sinal, que depende do referencial utilizado. A energia reticular pode ser obtida experimentalmente ou pode ser apenas calculada? Infelizmente a energia reticular não pode ser obtida experimentalmente. Ela pode apenas ser estimada, através do Ciclo de Born-Haber.
Max Born (1882-1970)
Fritz Haber (1868-1934) Ciclo de Born-Haber Em 1917, Born e Haber propuseram um ciclo
termodinâmico para o cálculo da energia de retículo de
substâncias iônicas a) Para compostos do tipo MX (por exemplo: NaCl, KBr, CsI etc.): 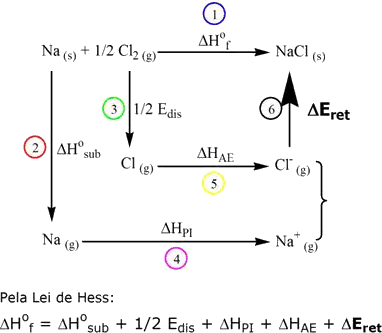
b) Para compostos do tipo MX2 (por exemplo: CaF2, MgBr2 etc.): 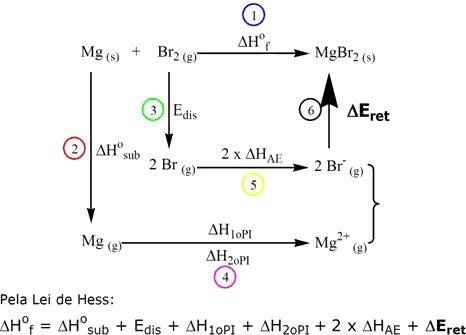
Com exceção do ΔEret, todos os outros valores são tabelados ou podem ser obtidos experimentalmente. As entalpias mostradas indicam:
Para que haja formação do cloreto de sódio, deve ocorrer transferência de elétrons (reação redox). O ciclo de Born-Haber tenta mostrar a energética das etapas envolvidas na reação entre as substâncias em suas formas elementares. No caso específico do cloreto de sódio, a transferência de elétrons se dá do sódio para o cloro. 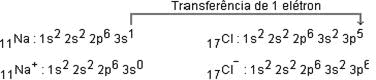
As etapas indicadas no ciclo de Born-Haber para o NaCl são as seguintes:
A energia potencial total é a soma de todas as energias envolvidas nas etapas. Portanto, a energia reticular expressa a força com que estão unidas as partículas de um sólido cristalino e depende da intensidade da força de interação entre os íons e da geometria do retículo. Quanto menor a distância interiônica cátion-ânion, maior a atração entre as cargas opostas, como você já viu na seção 2.1. A Tabela 3 lista alguns valores de ΔEret.
Em suma:
A possibilidade de formação do composto iônico a partir de seus elementos ocorre quando a diminuição da energia potencial for maior que o aumento. Em outras palavras, o sal só cristalizará se houver liberação de energia em sua formação. Sendo assim, a energia da rede exotérmica precisa ser maior que a combinação endotérmica dos fatores envolvidos na formação dos íons em fase gasosa. Caso contrário, o composto iônico não se forma ou forma uma rede cristalina instável. ATIVIDADE IIConsidere os dados termodinâmicos abaixo e calcule, usando o ciclo de Born-Haber, o valor de ΔEret para o cloreto de prata (AgCl) a 298 K. ΔHof (AgCl) = -127 kJ/mol ΔHosub (Ag) = +285 kJ/mol Edis (Cl2) = +240 kJ/mol ΔHPI (Ag) = +731 kJ/mol ΔHAE (Cl) = -349 kJ/mol Sabendo que o ΔEret para o sal AgBr é igual a -981 kJ/mol, diga qual composto iônico forma o retículo mais estável, AgCl ou AgBr?
4. Solubilidade das substâncias iônicasAs forças de atração e repulsão entre os íons e o seu arranjo geométrico são responsáveis pelas propriedades dos sólidos iônicos, bem como por seus altos pontos de fusão. Quando são fundidos, ocorre o afastamento entre os íons, as forças de interação são enfraquecidas e o retículo cristalino é destruído, permitindo a movimentação dos íons, de forma que, sob ação de um campo elétrico, eles se orientam e se movimentam de modo a estabelecer condutividade iônica por meio do líquido (material fundido). Os cristais iônicos oferecem resistência considerável ao rompimento do retículo, mas são solúveis em água. A solubilidade em água é justificada pelo fato de a molécula de água ser um dipolo elétrico (apresentar alta constante dielétrica), que, por atração eletrostática, separa os íons e destrói a rede cristalina. Assim, a água se caracteriza como um ótimo solvente para as substâncias iônicas. Leia um pouco mais sobre esse tema num excelente artigo publicado em 2004 em Química Nova, uma revista da Sociedade Brasileira de Química. Leia também sobre a diferença entre solubilização e solvatação. 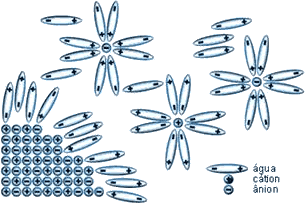 Dissolução e solvatação de um sólido iônico.
Este site foi atualizado em 04/03/19 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||