PROFESSOR
PAULO CESAR
|
PROFESSOR PAULO CESAR |
|
|
|
|
|
Módulo IIIA visão “quanto-mecânica” da ligação covalenteAula 8: Teoria dos orbitais moleculares (TOM) – parte II. Ligação metálicaMeta
Objetivo
Ligação metálicaOs metais exibem uma série de propriedades em comum: todos são sólidos nas condições ambientes (exceto Hg), têm brilho metálico, maleabilidade (possibilidade de se moldar em chapas), ductilidade (capacidade de formar fios), boa condutividade térmica e elétrica. Dê uma olhada na Aula 1 para relembrar as propriedades físicas dos metais. Para haver condutividade elétrica, é necessário o movimento de elétrons através do meio. A boa condutividade dos metais sugere que existam elétrons semilivres, fracamente ligados, nas estruturas metálicas, que possam ser forçados a se mover ao longo de todo retículo. Para compreender qualitativamente as diversas propriedades dos metais, é utilizado o modelo conhecido como “gás de elétrons”. Imagine o que acontece quando dois átomos de sódio se aproximam: cada um dos átomos tem um elétron mais externo que é fracamente atraído pelo respectivo núcleo (elétron 3s). Se a distância entre os átomos for diminuindo, os elétrons 3s serão atraídos simultaneamente pelos dois núcleos. O que ocorreria se, ao invés de dois, milhares de átomos de sódio se aproximassem para formar uma substância metálica? Nesse caso, teríamos uma situação na qual cada elétron 3s seria atraído por um grande número de núcleos e, assim, poderia se movimentar livremente nas regiões próximas a todos os núcleos. Em conseqüência disso, não seria mais possível atribuir um determinado elétron a um certo núcleo. No modelo do “gás de elétrons”, todos os átomos são considerados íons positivos que compartilham entre si um igual número de elétrons que podem se movimentar livremente ao longo de toda a estrutura metálica. E a repulsão entre os íons positivos? Como na estrutura metálica, segundo o modelo do “gás de elétrons”, todos os íons compartilham elétrons, a repulsão entre os cátions é compensada pela atração eletrostática entre os elétrons livres e os íons positivos. Os elétrons livres funcionam como uma “cola” eletrostática, ligando os cátions metálicos. 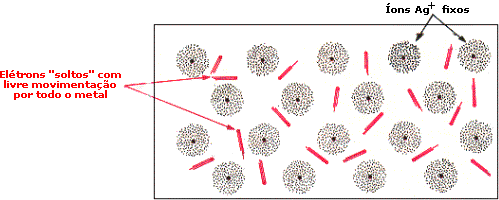 Modelo do “gás de elétrons”. Os elétrons de valência não estão ligados aos átomos, mas deslocalizados por todo o cristal, movendo-se livremente em todas as direções e sendo compartilhados por todos os cátions com igual probabilidade. No caso dos metais maleáveis (facilmente deformáveis), como sódio, chumbo, mercúrio e outros, os elétrons livres podem se ajustar rapidamente às mudanças na estrutura metálica provocadas por perturbações externas. Você pode bater numa lata para tirar um som e mesmo assim não destruirá a ligação metálica, pois, sob a influência de uma ação mecânica, um plano de átomos pode se deslizar sobre outro, mantendo as ligações entre os planos. Isso explica as propriedades de maleabilidade e ductilidade (formação de fios) dos metais. 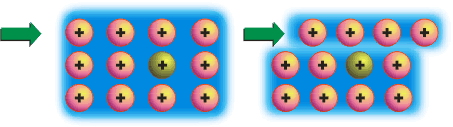 Deslocamento entre planos de cátions numa substância metálica. Os átomos de um metal no estado sólido estão arranjados de modo a formar figuras geométricas bem definidas – os retículos cristalinos. Observe o arranjo estrutural dos metais sódio, lítio e bário. Cada átomo tem ao seu redor oito átomos vizinhos, formando uma estrutura cúbica de corpo centrado (ccc). 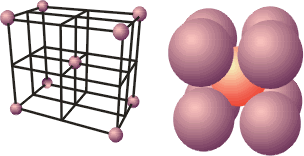 Estrutura ccc. O ponto de fusão e de ebulição dos metais varia de acordo com a estrutura cristalina e intensidade das ligações metálicas. Por exemplo, o sódio funde a 97,8oC; o magnésio funde a 6.500oC; e o tungstênio funde a 3.410oC. Como justificar o comportamento diferenciado dos metais? Existe um modelo mais elaborado para descrever as ligações químicas em metais? Até agora você pôde compreender as características dos metais utilizando o modelo do “gás de elétrons”. Chegou o momento de utilizar um modelo mais aperfeiçoado. O desenvolvimento da teoria dos orbitais moleculares (TOM) permite descrever as propriedades dos metais. Considerando quatro átomos de lítio (Li4) (lembre-se dos OMs do Li2, representados na Figura 4 da Aula 7). Se cada átomo do metal contribuir com um orbital atômico do tipo 2s e um do tipo 2p para a formação de OMs, oito orbitais moleculares (4 ligantes e 4 antiligantes) serão formados. Se forem 400 átomos de lítio contribuindo com orbitais 2s e 2p, formam-se 1.600 OMs. À medida que o número de átomos aumenta, o número de orbitais moleculares também aumenta. Num cristal de lítio com 1g de massa existem cerca de 9x1022 átomos, que podem formar 36x1022 OMs. Os orbitais moleculares numa substância metálica estão deslocalizados por todo o retículo cristalino e podem se reunir numa banda de orbitais moleculares cujas energias são muito próximas. Uma banda quase contínua é construída por tantos níveis quantos forem os orbitais atômicos participantes. Cada nível pode conter dois elétrons de spins opostos. Você vai começar agora a estudar a Teoria de Bandas. 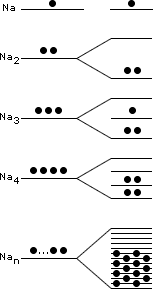 Bandas de orbitais moleculares no sódio metálico (Nan). As bandas são constituídas de níveis discretos, muito próximos em energia. No limite inferior das bandas (menor energia), os OMs são totalmente ligantes; no limite superior, são totalmente antiligantes. Uma região de orbitais moleculares vazios ou incompletos é chamada banda de condutividade. A região contendo orbitais preenchidos é chamada banda de valência. Como os orbitais vizinhos têm energias muito próximas, eles precisam de pequena energia adicional para excitar um elétron do orbital molecular de mais alta energia (chamado HOMO) para o orbital vazio localizado logo acima (chamado LUMO). Esses elétrons podem se movimentar livremente ao longo do sólido, conferindo ao metal as propriedades da condutividade elétrica e térmica. Quando a absorção de um fóton provoca a promoção de um elétron do metal para um estado de energia mais elevado, há um fenômeno de excitação eletrônica. Logo após a excitação, pode haver emissão espontânea do fóton absorvido, fazendo com que o elétron retorne ao seu nível fundamental. Por causa dessa rápida emissão de luz, a superfície de um metal é refletora e tem brilho típico. A resistência dos metais aumenta com a temperatura porque, quando aquecidos, os átomos vibram mais vigorosamente. Os elétrons em movimento colidem com os átomos, dificultando sua movimentação, diminuindo a condutividade elétrica. Como a teoria de bandas explica a formação de um isolante e de um semicondutor elétrico? Um isolante elétrico, como o diamante, tem a banda de valência completamente preenchida, e os níveis vazios (banda de condução) exibem energias muito elevadas, impossibilitando a promoção de um elétron à banda de condução. Assim, não há surgimento de corrente elétrica – não existe deslocamento de cargas. 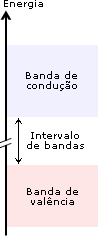 Bandas num isolante. Existem elementos químicos semicondutores que apresentam banda de condução vazia com energia próxima à banda de valência completa. Quando o semicondutor é aquecido, elétrons podem ser excitados da banda de valência para a de condução. Assim, a resistência de um semicondutor diminui com o aumento da temperatura. A capacidade de um semicondutor de transportar corrente elétrica pode ser ampliada com a adição de elétrons na banda de condução ou com a remoção de elétrons da banda de valência. Esses processos são feitos espalhando pequenas quantidades de impurezas nos sólidos. Este procedimento é chamado de dopagem. Como exemplo, você pode estudar o caso do silício de alta pureza, que é um semicondutor. Uma dopagem que pode ser feita ao Si (Z = 14; 4 elétrons de valência) é a inclusão de uma quantidade de elemento do grupo 15, como arsênio, que tem cinco elétrons de valência. Os elétrons adicionais entram na banda de condução do silício e permitem que ele conduza a corrente elétrica mais facilmente. Este é um exemplo de semicondutor do tipo n, porque tem excesso de elétrons. 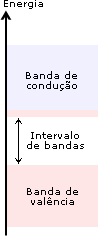 Semicondutor tipo n. Quando o silício é dopado com índio (grupo 13), a estrutura terá menos elétrons de valência – a banda de valência não estará completamente preenchida. Neste caso, tem-se um semicondutor do tipo p, que apresenta “buracos” positivamente carregados na banda de valência. A migração de elétrons dentro da banda de valência é responsável pela condutividade num semicondutor do tipo p. 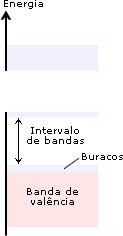 Semicondutor tipo p. Clique aqui para ler mais sobre teoria de bandas. De maneira geral, ligações em sólidos podem ser descritas em termos de bandas (conjuntos) de orbitais moleculares. Em metais (condutores), as bandas de condução são orbitais não totalmente preenchidos que permitem que os elétrons fluam. Nos isolantes, as bandas de valência estão completas e a grande distância energética entre as bandas de condução e valência evita o deslocamento dos elétrons para os orbitais vazios. Nos semicondutores, níveis vazios estão próximos, em energia, aos níveis completos. ATIVIDADE IO germânio é um semicondutor, incluindo pequenas quantidades de impurezas. Considere o fósforo (grupo 15) e o gálio (grupo 13). Qual deles fará com que o germânio se transforme em: a) semicondutor do tipo p?
Este site foi atualizado em 04/03/19 |