PROFESSOR
PAULO CESAR
|
PROFESSOR PAULO CESAR |
|
|
|
|
|
Módulo IIA visão “clássica” da ligação covalenteAula 4: Geometria e polaridade de moléculas (parte I)Metas
ObjetivoDeterminar a polaridade de moléculas de elementos representativos.
Índice 3. Introdução à teoria de repulsão dos pares eletrônicos na camada de valência (RPECV)
1. IntroduçãoVocê viu na aula passada que a eletronegatividade (X) de um elemento, como definida por Pauling, é seu “poder” de atrair elétrons numa molécula. Portanto, se dois átomos com a mesma eletronegatividade se ligarem, a distribuição de carga elétrica na ligação será simétrica (homogênea), como ocorre nas moléculas diatômicas homonucleares, como H2, O2 e Cl2. Por outro lado, quando átomos com eletronegatividades diferentes se combinam, a nuvem eletrônica da ligação é polarizada (deslocada) no sentido do elemento mais eletronegativo. Por exemplo: na molécula de cloreto de hidrogênio (HCl), o átomo de cloro (mais eletronegativo) atrai densidade eletrônica da ligação, levando à formação de um dipolo elétrico. A ligação química no HCl é covalente polar. 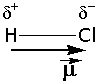 O primeiro cientista a sugerir uma escala de eletronegatividade foi Linus Pauling em 1932; ele propôs o valor de 4,0 para a eletronegatividade do flúor (mais eletronegativo) e o valor de 0,4 para a eletronegatividade do frâncio – o menos eletronegativo. Os demais elementos exibem, por conseguinte, valores intermediários de eletronegatividade. Veja na Figura 1 alguns valores de eletronegatividade sugeridos por Pauling. Foram desenvolvidas outras escalas de eletronegatividade mais elaboradas. No entanto, para uma abordagem inicial, a proposta de Pauling é extremamente eficiente. Clique aqui para ler mais sobre outras escalas de eletronegatividade. Eletronegatividade não é uma propriedade restrita aos elementos químicos; é possível também encontrar valores tabelados de eletronegatividade para grupos de átomos (XG), como CH3 (XG = 2,34), CF3 (XG = 3,3), NH2 (XG = 1,7 - 3,4 ) e OH (XG = 2,3 - 3,9).
Figura 1. Escala de eletronegatividade de Pauling. A diferença de eletronegatividade (Δx) entre dois átomos ligados pode ser usada para estimar a natureza polar da ligação química, assim como seu caráter iônico. Você viu na aula passada que, quanto maior a diferença de eletronegatividade de Pauling, mais polar é a ligação entre os átomos e maior é a porcentagem de caráter iônico da ligação. Ligações homonucleares (entre átomos iguais) são apolares e ligações heteronucleares (entre átomos diferentes) são polares. O grau de polarização pode ser qualitativamente analisado pela diferença de eletronegatividade entre os elementos. É possível afirmar que, se essa diferença for maior ou igual a 2,0, a ligação é predominantemente iônica (grau máximo de polarização do par da ligação). Se a Δx for menor ou igual a 1,0, seguramente a ligação é covalente polar. Valores de Δx entre 2,0 e 1,0 por si só não são suficientes na determinação da natureza polar das ligações químicas. Nesses casos, é necessário lançar mão de alguma propriedade química ou física que sinalize a natureza iônica ou não da ligação. A tabela a seguir ilustra três situações distintas. Uma maneira de se verificar a predominância ou não de ligação iônica numa substância é medindo sua condutividade elétrica no estado sólido e, depois, em solução aquosa. A ausência de condutividade elétrica no sólido e uma alta condutividade em solução são características de substâncias com predominância de ligação iônica.
ATIVIDADE I1) Calcule a diferença de eletronegatividade (Δx) entre os elementos ligados e estime, se possível, a natureza polar (iônica ou covalente polar) da ligação química.
2. Polaridade de moléculasApós analisar o caráter polar (ou iônico) de uma ligação química, você vai estudar nesta seção como julgar a polaridade de uma molécula poliatômica a partir do sentido dos vetores momento de dipolo de cada ligação covalente polar. Considere que o vetor momento de dipolo (
Moléculas diatômicas heteronucleares são
moléculas polares, uma vez que possuem
As moléculas CO2
(geometria linear), BF3
(geometria triangular ou trigonal plana) e CCl4
(geometria tetraédrica) são apolares, embora sejam constituídas de
ligações covalentes polares. Veja a Figura 2, a seguir. Nessas
moléculas, os momentos de dipolo individuais são cancelados
mutuamente em virtude das geometrias moleculares, fazendo com que o
vetor momento de dipolo resultante,
Figura 2. Moléculas apolares
Curiosamente, por causa das geometrias moleculares, muitos ânions poliatômicos (moléculas com carga negativa) são apolares, apesar de formarem compostos iônicos com cátions, como: NO3-, SO42-, PO43- etc. Nas moléculas de H2O,
NF3 e CHCl3
(clorofórmio), por exemplo, os momentos de dipolo das ligações não
se anulam, e as moléculas são ditas polares, já que
Figura 3. Moléculas polares:
A Tabela 1 mostra alguns valores de momentos de dipolo moleculares obtidos experimentalmente.
3. Introdução à teoria de repulsão dos pares eletrônicos na camada de valência (RPECV)Nas moléculas, é possível distinguir dois tipos de pares de elétrons:
A molécula da água exibe dois pares ligados e dois isolados ao redor do átomo central (oxigênio). Na formação das moléculas, os pares eletrônicos ligantes e não ligantes vão se arranjando espacialmente de maneira a minimizar as repulsões entre si. Dessa forma, a geometria molecular é moldada em função da minimização da repulsão entre os pares eletrônicos. O modelo que preconiza esse comportamento é conhecido como teoria de repulsão dos pares eletrônicos na camada de valência (RPECV) ou VSEPR, em inglês (valence-shell electron-pair repulsion). O modelo RPECV considera que os pares ligados e isolados não se repelem entre si com a mesma intensidade. Segundo o modelo RPECV, pares isolados ocupam mais espaço que pares ligados, provocando maiores distorções nas geometrias. Considere a ordem crescente de intensidade de repulsão eletrônica a seguir.
O uso da teoria RPECV na estimativa da geometria das mais variadas moléculas é o tema da próxima aula. ATIVIDADE II1) Desenhe as estruturas de Lewis para as moléculas a seguir e determine quantos pares ligados e quantos pares isolados existem ao redor do átomo central.
Este site foi atualizado em 04/03/19 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||