PROFESSOR
PAULO CESAR
|
PROFESSOR PAULO CESAR |
|
|
|
|
|
Módulo IIIA visão “quanto-mecânica” da ligação covalenteAula 7: Teoria dos orbitais moleculares (TOM) – parte IMeta
Objetivo
Teoria dos orbitais moleculares (TOM) – parte IDe acordo com a teoria de ligação de valência (TLV), a formação de uma ligação covalente se dá através do entrosamento (superposição) entre dois orbitais atômicos monoocupados, sejam eles híbridos ou não. A descrição de uma ligação química à luz da TLV reflete as idéias intuitivamente químicas de formação de uma ligação através da aproximação de dois átomos e conseqüente interação entre suas camadas de valência. De acordo com a TLV clássica, a molécula de oxigênio (O2) exibe todos os elétrons emparelhados. Em outras palavras: a TLV clássica sugere que a molécula de O2 seja diamagnética. É importante ressaltar que o O2 desempenha um papel importante em diversas transformações químicas, sejam elas de relevância bioquímica, ambiental ou tecnológica. Por isso, é extremamente importante descrever corretamente a estrutura química do dioxigênio em seu estado eletrônico fundamental e também em seus estados excitados. Clique aqui para ler um pouco sobre as espécies reativas de oxigênio. 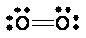 Estrutura de Lewis para o O2. No final da década de 1920 foi realizado um experimento para verificar a natureza magnética do O2. Primeiramente, O2 foi resfriado até ser liquefeito. O2 líquido foi então colocado entre os pólos de um magneto. Ao invés de fluir (ser repelido) por ambos os pólos, o líquido ficou “agarrado” (atraído) pelos pólos. Descobriu-se, portanto, que a molécula de O2 é paramagnética, ou seja, tem elétrons desemparelhados e, conseqüentemente, momento magnético de spin permanente. O dado experimental acerca do paramagnetismo do dioxigênio contradiz a descrição de Lewis e da TLV clássica. Estudos comprovaram que, no estado eletrônico fundamental, O2 é, na verdade, um bi-radical, isto é, tem dois elétrons desemparelhados. Agora você pode até imaginar uma maneira de reescrever a estrutura de Lewis para o O2 levando em conta seu paramagnetismo. Uma proposta seria:  Estrutura de Lewis proposta para o bi-radical O2. Em azul estão os elétrons desemparelhados. Há contração de octeto.
Para ler um pouco mais sobre o magnetismo de substâncias, visite http://pt.wikipedia.org/wiki/Magnetismo. Ligue-se:Quando, numa molécula, existem elétrons desemparelhados (espécies radicalares), ocorre paramagnetismo, isto é, a molécula é atraída por um campo magnético; se os elétrons estão emparelhados, a molécula não apresenta momento magnético de spin, sendo então diamagnética. Os materiais mais comuns são diamagnéticos; logo, tendem a ser repelidos por um campo magnético externo. Esse efeito pode ser detectado com uma balança de Gouy.  Balança de Gouy. Compostos paramagnéticos tendem a se mover na direção do campo magnético e parecem pesar mais na presença de um campo magnético do que na ausência dele. Para você estudar a questão do magnetismo de substâncias é introduzida nesta aula a Teoria dos Orbitais Moleculares (TOM). Nesta teoria, a idéia de orbital atômico localizado é substituída pela idéia de orbitais moleculares (OMs), deslocalizados por toda a molécula (Figura 1). Os OMs são construídos a partir da combinação linear de orbitais atômicos de átomos distintos. Vale relembrar que a idéia apresentada aqui é diferente da idéia que está por trás da hibridação de orbitais atômicos. Neste último caso, é feita uma combinação entre orbitais atômicos de um mesmo átomo. Um orbital molecular, por sua vez, é construído pela combinação linear de orbitais atômicos de átomos diferentes. 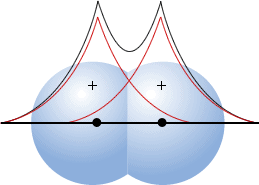 Figura 1. Orbital molecular (s1s) construído pela superposição entre dois orbitais 1s. Um OM pode ter energia menor ou maior que a dos orbitais atômicos usados na sua construção. Os orbitais atômicos são como ondas estacionárias centradas (localizadas) nos núcleos atômicos. Entre núcleos distintos, as ondas podem interferir construtivamente entre si, de maneira a aumentar a amplitude total da onda na região internuclear. Nesse ponto, é possível indicar uma região de grande probabilidade de o elétron ser encontrado, caracterizando um sistema ligado. O primeiro princípio da teoria dos orbitais moleculares diz que N orbitais atômicos se combinam linearmente, formando N orbitais moleculares. Para o hidrogênio molecular (H2) são esperados dois orbitais moleculares, que resultam da combinação linear entre dois orbitais atômicos 1s. Um dos OMs gerados apresenta amplitude não-nula (Figura 1) na região da ligação (região internuclear). Esse orbital molecular, construído pela interferência construtiva (combinação positiva) entre os orbitais 1s, é chamado orbital molecular ligante, denominado orbital σ1s. Na formação do segundo orbital molecular, os dois orbitais 1s interferem de maneira destrutiva. Assim, a densidade de elétrons aumenta nas regiões distantes do espaço entre os átomos, mas é zero na região internuclear. Existe um plano nodal na região internuclear. Este OM é, então, denominado orbital molecular antiligante (σ*1s). O asterisco (*) é usado para designar um orbital molecular antiligante. O segundo princípio diz que o OM ligante tem energia mais baixa que os orbitais atômicos dos quais ele é originado, e o OM antiligante tem energia mais alta. O terceiro princípio diz que os elétrons da molécula são distribuídos sucessivamente nos orbitais moleculares em ordem crescente de energia, conforme o Princípio de Pauling e a Regra de Hund. O quarto princípio diz que a combinação de orbitais atômicos para formar OMs é mais eficaz quando os orbitais atômicos têm energias e simetrias semelhantes. Veja nas Figuras 2 e 3 os diagramas de orbitais moleculares para H2 e He2, respectivamente. 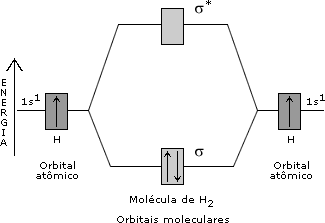 Figura 2. Diagrama de orbitais moleculares para H2.
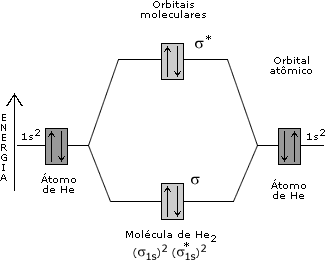 Figura 3. Diagrama de orbitais moleculares para He2. Como você determina uma configuração eletrônica para um átomo, é possível determinar configurações eletrônicas para moléculas em termos dos orbitais moleculares. Para o H2 tem-se a configuração (s1s)2, e no He2, a configuração (s1s)2(s*1s)2. Como você viu nas Aulas 3 e 4, numa estrutura de Lewis a ordem de ligação de uma molécula é definida como o número de pares de elétrons que une os átomos. Na TOM, a ordem de ligação é definida pela expressão: 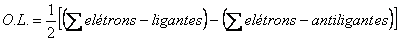 Pelas configurações eletrônicas moleculares, é possível calcular as ordens de ligação nas moléculas de H2 e He2 (Figuras 2 e 3). No H2, a ordem da ligação é igual a um e no He2 é zero. Isso significa que não há ligação química no He2, evidenciando a instabilidade dessa molécula. É curioso perceber que, apesar de a molécula de He2 ser instável, a molécula de He2+ [(s1s)2(s*1s)1]pode existir, já que neste último exemplo a O.L. = ½. Olhando para a configuração eletrônica do Li (1s2 2s1), é possível construir um diagrama de orbitais moleculares para o Li2 (Figura 4). Pela Figura 4, a configuração eletrônica do Li2 é (s1s)2(s*1s)2(s2s)2, o que resulta numa O.L. = 1. 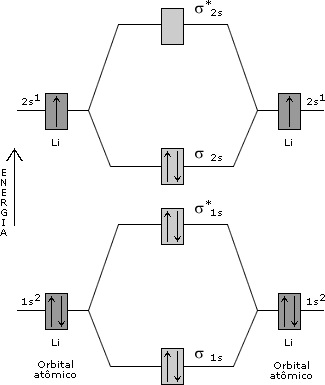 Figura 4. Diagrama de orbitais moleculares para o Li2. No Li2, o efeito ligante dos elétrons no orbital σ1s é cancelado pelo efeito antiligante dos elétrons no orbital σ*1s. A ligação química se deve ao par de elétrons que ocupa o orbital σ2s, sendo a O. L. igual a 1. Como todos os elétrons estão emparelhados nos orbitais moleculares, a molécula de Li2 é diamagnética. Observe na Figura 5 um diagrama de OMs para a molécula de O2. 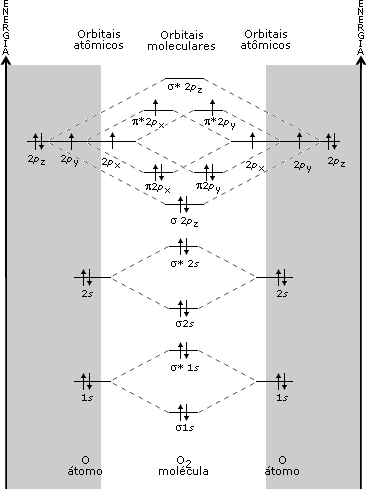 Figura 5. Diagrama de orbitais moleculares da molécula de O2. A configuração eletrônica para o dioxigênio é: (s1s)2(s*1s)2(s2s)2(s*2s)2(s2pz)2(p2px)2(p2py)2(p*2px)1(p*2py)1. A partir desta configuração, a O.L. para o O2 é igual a 2. Experimentalmente, a molécula de O2 é paramagnética, pois apresenta elétrons desemparelhados. Pelo diagrama de orbitais moleculares do O2 (Figura 5), você pode perceber que os dois últimos orbitais preenchidos têm um elétron (desemparelhado) cada. O modelo TOM tem sido, então, vastamente empregado para explicar as propriedades magnéticas do O2 e de diversas outras moléculas com razoável sucesso. ATIVIDADE I
Ligue-seExiste fronteira entre a ligação iônica e a ligação covalente? Uma análise útil para obter resposta para essa pergunta envolve raios iônicos. Dependendo do raio, o íon pode se tornar uma espécie química polarizante (conhecida como íon duro) ou polarizável (íon macio ou mole). A capacidade de certos íons de distorcer nuvens eletrônicas de íons próximos induz a uma covalência parcial dos compostos iônicos (veja as Regras de Fajans na Aula 1). Uma espécie química dura apresenta eletronegatividade relativamente alta e, principalmente, pequeno raio iônico. A espécie dura é polarizante, sendo, portanto, desfavorecida a distorção de sua nuvem eletrônica. Em vez disso, uma espécie dura promove a distorção da nuvem eletrônica de íons vizinhos. Como exemplos podem ser citados os cátions H+, Li+, Na+, Be2+, Al3+, Cr3+. Quanto maior a carga iônica, menor é o raio iônico e mais duro é o íon em questão. Os íons moles (ou macios), ao contrário, por serem volumosos e de eletronegatividade relativamente mais baixa, são extremamente polarizáveis, ou seja, apresentam alta capacidade de sofrer distorções. Como exemplo podem ser citados os cátions Ag+, Cd2+, Cu+ e Hg2+ e os ânions Br- e I-. Uma interação entre cátion polarizante e ânion polarizante favorece as contribuições iônicas na formação dos retículos salinos. O gradiente de deformação depende da diferença entre as eletronegatividades dos elementos e ajuda a estabelecer a natureza da ligação, justificando o comportamento químico das substâncias. Uma interação entre cátion polarizante e ânion polarizável favorece as contribuições covalentes na formação dos retículos iônicos, nos quais haverá a aproximação cátion–ânion até uma distância mínima. O efeito da deformação é o aumento da densidade eletrônica na região interiônica que origina a formação de uma covalência parcial (caráter covalente parcial) no retículo. Para os cátions duros, a estabilidade dos compostos segue geralmente a ordem abaixo: F- > Cl- > Br- > I- O2- >> S2- > Se2- > Te2- N3- >> P3- > As3- > Sb3- Para cátions macios: I- > Br- > Cl- > F- Te2- ≈ Se2- ≈ S2- >> O2- Sb3- < As3- < P3- << N3-
Este site foi atualizado em 04/03/19 |