PROFESSOR
PAULO CESAR
|
PROFESSOR PAULO CESAR |
|
|
|
|
|
Módulo IIA visão “clássica” da ligação covalenteAula 5: Geometria e polaridade de moléculas (parte II)Meta
Objetivos
1. Teoria de repulsão dos pares eletrônicos na camada de valência (RPECV)O modelo RPECV foi introduzido por Gillespie e Nyholm na década de 1950, com o intuito de auxiliar a previsão de geometrias moleculares a partir de estruturas de Lewis. O modelo RPECV é uma ferramenta extremamente poderosa na determinação de estruturas de moléculas de elementos representativos. As estimativas de geometria providenciadas pela teoria RPECV têm sido confirmadas por dados experimentais. De acordo com o modelo RPECV, apenas a repulsão entre pares isolados (p.i.) e pares ligados (p.l.) ao redor do átomo central são relevantes na determinação das geometrias. Pode ser estabelecida a seguinte ordem crescente de influência na determinação de geometrias: repulsão p.l-p.l. < p.l.-p.i. < p.i.-p.i. Na molécula de amônia (NH3), a geometria é piramidal triangular (Figura 1). Se o par isolado tivesse a mesma influência que os pares ligados (as três ligações N-H), o ângulo de ligação Ð HNH se assemelharia ao ângulo interno de um tetraedro regular: 109,5º. Entretanto, o ângulo Ð HNH = 107º.
Figura 1. Molécula da amônia.Ð HNH = 107º (LP significa par isolado).
O parâmetro geométrico mais importante no estudo das geometrias moleculares é o ângulo de ligação. O ângulo de ligação (simbolizado por Ð ) é definido por três átomos. Fique ligado: todas as moléculas diatômicas são lineares. Como usar a teoria RPECV? Para utilizar a teoria RPECV, basta seguir o procedimento a seguir:
A Tabela 2 lista valores de ângulos de ligação
experimentais obtidos para diversas moléculas simples. A
polaridade das moléculas também é dicutida nessa tabela. Não
se esqueça que, para
Sugestão: desenhe a estrutura de Lewis para cada uma das moléculas mostradas na Tabela 2 e tente chegar às mesmas conclusões acerca das polaridades. Ligue-se: Recurso didático: construindo modelosPara facilitar a compreensão dos arranjos geométricos das moléculas por seus alunos, você pode utilizar modelos feitos com materiais simples e acessíveis. Dê uma olhada na sugestão a seguir. Material:
Procedimento:Faça um orifício em cada ponta de todos ovos plásticos. Transpasse um pedaço de linha pelo interior de um ovo e prenda-o, fazendo um nó numa das pontas da linha. Repita a operação com mais outros dois ovos. Pegue as três pontas das linhas que estão livres e passe através do quarto ovo. Segurando o quarto ovo, puxe uma das linhas com a outra mão. Os ovos se repelem, assumindo a geometria linear. Puxando duas linhas, o grupo assume a geometria triangular plana. Ao puxar as três linhas, os ovos assumem uma geometria tetraédrica. Os pares de elétrons não compartilhados são representados retirando-se a tampa do ovo. Agora ficará mais fácil estudar o modelo RPECV para prever geometrias moleculares e, conseqüentemente, as polaridades das moléculas! Existem outras maneiras de mostrar modelos moleculares. Podem ser usadas bexigas ou bolas de isopor (átomos) com palito de madeira (ligações), entre outras. Crie a sua e torne o aprendizado da Química uma diversão para os seus alunos. 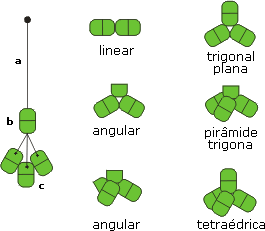 ATIVIDADE I1. Faça a previsão da geometria das moléculas a seguir e estime sua polaridade considerando a soma vetorial dos momentos de dipolo individuais. Dica: use a escala de eletronegatividade de Pauling para determinar o sentido do vetor momento de dipolo de cada ligação.
Este site foi atualizado em 04/03/19 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||