PROFESSOR
PAULO CESAR
|
PROFESSOR PAULO CESAR |
|
|
|
|
|
A Química na cozinha apresenta: A PIMENTA
Introdução
Há uma maneira hábil de obter um favor de Exu. É preparar-lhe um golpe mais astuto que aqueles que ele mesmo prepara. Conta-se que Aluman estava desesperado com uma grande seca. Seus campos estavam áridos, a chuva não caía. As rãs choravam de tanta sede e os rios estavam cobertos de folhas mortas, caídas das árvores. Nenhum orixá invocado escutou suas queixas e seus gemidos. Aluman decidiu, então, oferecer a Exu grandes pedaços de carne de bode. Exu comeu com apetite essa excelente oferenda. Só que Aluman havia temperado a carne com um molho muito apimentado. Exu teve sede. Uma sede tão grande que toda a água de todas as jarras que ele tinha em casa, e que tinham, em suas casas, os vizinhos, não foi suficiente para matar sua sede! Exu foi à torneira da chuva e abriu-a sem pena. A chuva caiu. Ela caiu de dia, ela caiu de noite. Ela caiu no dia seguinte e no dia depois, sem parar. Os campos de Aluman tornaram-se verdes. Todos os vizinhos de Aluman cantaram sua glória. E as rãzinhas gargarejavam e coaxavam, e o rio corria velozmente para não transbordar! Aluman, reconhecido, ofereceu a Exu carne de bode com o tempero no ponto certo da pimenta. Havia chovido bastante. Mais, seria desastroso! Pois, em todas as coisas, o demais é inimigo do bom (Lendas Africanas dos Orixás, de Pierre Fatumbi Verger). Pimenta (do sânscrito, pippali) é o nome dado a diversos condimentos que provocam sensação de ardência ao serem ingeridos. São denominados pimenta:
 Pimentas-do-Reino branca e preta
 Frutos de Capsicum sp. 
 Pimenta-da-jamaica
 Sabiá em um galho de aroeira; repare nos frutos vermelhos (pimenta-rosa)
 Nigela Piperina e capsaicinaOs principais constituintes químicos da pimenta do reino e da pimenta malagueta são amidas, denominadas, respectivamente, piperina e capsaicina. A piperina é um alcalóide de caráter lipofílico presente na pimenta-do-reino e possui diversas atividades farmacológicas, como antiinflamatória, antifertilidade e estimuladora da biossíntese de serotonina no Sistema Nervoso Central, além de ser utilizada como inseticida. Hans Christian Orstead, cientista dinamarquês que descobriu o eletromagnetismo induzido por correntes elétricas, foi também quem descobriu a presença da piperina na pimenta-do-reino, em 1820. Sua síntese química, entretanto, só foi realizada pela primeira vez em 1882 por Leopold Hugheimer, químico alemão famoso por sua metodologia de síntese de pirazinas, a síntese de Staedel-Hugheimer. A piperina é um inibidor das enzimas hepáticas de metabolismo de fármacos, denominadas citocromos P450. Por isso, ela acaba aumentando o tempo de meia-vida de muitos fármacos, fazendo com que a eliminação deles seja mais lenta, o que pode levar a quadros de intoxicação.
Outro alcalóide presente na pimenta-do-reino é a chavicina, um isômero da piperina. Acredita-se que esta amida seja o principal responsável pelo sabor pungente da pimenta, e que sua lenta conversão à piperina seja responsável pela perda dessa característica em preparados de pimenta. Essa conversão pode ocorrer por fotoisomerização, convertendo a ligação dupla de estereoquímica Z em uma ligação com estereoquímica E.
Por sua vez, a capsaicina é o alcalóide amídico presente nas pimentas do gênero Capsicum. Foi isolado em três estudos diferentes conduzidos ao longo do século XIX (Buchohz em 1816, Thresh em 1846 e Hogyes em 1878), tendo sido sintetizada pela primeira vez em 1930 por Spatti e Darling. Como a piperina, a capsaicina é uma amida de caráter lipofílico, possuindo atividade analgésica, especialmente para lesões associadas à artrite, embora seu uso não seja regulamentado oficialmente. Esta atividade parece estar associada a uma hiperexcitação dos nociceptores (receptores de dor) pela capsaicina, esgotando os estoques de neurotransmissores e deixando-os refratários aos estímulos dolorosos provocados pela doença. Ela vem sendo estudada também no tratamento de diabetes e de diversos tipos de câncer. O uso mais consagrado da capsaicina, entretanto, é como agente ativo do chamado gás de pimenta, usado pelas forças policiais para o controle de situações de distúrbio público e agressões; quando em contato com mucosas, especialmente a ocular, provoca dor extrema.
Tanto a capsaicina quanto a piperina são ativadores de uma proteína denominada receptor vanilóide. Esse receptor é acoplado a um canal iônico, e sua ativação, por seus agonistas (como a piperina e a capsaicina), leva à entrada de íons sódio no neurônio, despolarizando-o. No entanto, a exposição prolongada à capsaicina pode causar morte celular por excesso de influxo de íons cálcio, que é letal para a célula (daí seu uso potencial no tratamento do câncer, porque levaria à morte as células tumorais). Existem indícios de que esses receptores também são ativados pelo calor, daí a sensação de ardência provocada pelos alcalóides das pimentas. É interessante notar que nem todos os neurônios são sensíveis à capsaicina: aqueles localizados no SNC (encéfalo e medula espinhal) não sofrem os efeitos dessa substância. A sensação de ardência causada pelas pimentas pode ser aliviada pela ingestão de leite (de preferência bochechando-se o leite na boca) ou consumindo miolo de pão. O efeito do leite parece se dar pela interação da capsaicina com a caseína, uma fosfoproteína presente no leite. Beber água não adianta, porque a capsaicina é insolúvel em água, mas solúvel em etanol e em óleos (associe esta informação com a lenda contada no início da aula!). Pode se evitar também uma ardência exagerada removendo as sementes e a parte branca da pimenta-malagueta, pois é aí que se concentra a capsaicina.
Outro fato interessante é que a capsaicina não provoca sensações desagradáveis em aves e insetos, que, assim, se alimentam da pimenta e ajudam a disseminar suas sementes. Já ao atuar em mamíferos, ela reduz a palatabilidade de seu “predador”. Esta é uma adaptação evolutiva muito interessante que pode ser discutida com os alunos em sala de aula!
Nomenclatura das amidasA nomenclatura de amidas é feita com base no ácido carboxílico correspondente. No caso de amidas primárias, substitui-se o termo óico pelo sufixo amida ou, no caso de derivados de hidrocarbonetos cíclicos, carboxamida:  No caso de amidas secundárias e terciárias, deve-se colocar o nome dos radicais hidrocarbônicos ligados ao átomo de nitrogênio antes do nome da amida, colocando a letra N- antes do nome do radical, de forma a deixar claro que este é um substituinte do nitrogênio amídico e não da cadeia hidrocarbônica da amida:   Amidas derivadas de anilinas são conhecidas também como anilidas.  Amidas cíclicas são denominadas lactamas. Sua nomenclatura é feita como a anterior, substituindo o sufixo ico pelo sufixo lactama. Também se adiciona uma letra grega para referenciar o tamanho do anel (β para anéis de 4 membros, γ para anéis de cinco membros, δ para anéis de seis membros):  As penicilinas são um grupo de lactamas presente no nosso dia-a-dia. Esses medicamentos antibióticos são empregados no tratamento de diversas infecções; produzidos por fungos do gênero Penicillium, é muito famosa a história de sua descoberta por Alexander Flemming, cheia de fatos curiosos. A atividade antibacteriana das penicilinas se deve à alta reatividade do anel beta-lactâmico, que reage com um resíduo do aminoácido serina presente na estrutura de enzimas responsáveis pela síntese da parede celular nas bactérias, causando a morte destas. Entretanto, o uso indiscriminado desses medicamentos levou ao surgimento de bactérias resistentes, capazes de promover doenças graves, como as chamadas infecções hospitalares. O médico húngaro Ignaz Semmelweis foi o grande elucidador do papel dos microorganismos nas infecções hospitalares, e sua trágica história de vida mostra o empenho de um cientista em aplicar o método científico para resolver um problema, e como questões políticas e preconceitos podem prejudicar esta tarefa. 
Estrutura das amidasAs amidas primárias e secundárias apresentam propriedades físicas e químicas determinadas principalmente por sua capacidade de formar ligações hidrogênio. Assim, da mesma forma que os ácidos carboxílicos, elas podem existir na forma de dímeros:  Esse tipo de interação promove maior associação entre as moléculas, conferindo às amidas primárias e secundárias maiores valores de ponto de fusão e ebulição que as amidas terciárias de mesmo número de átomos de carbono, já que estas não podem se associar em dímeros devido à ausência de ligações N-H:
Também devido a essa forte interação entre as moléculas de amidas primárias e secundárias, sua solubilidade em água é menor que a das amidas terciárias de mesmo número de átomos de carbono, por requerer maior energia para romper as interações soluto-soluto para formar as interações soluto-solvente. Outro fator muito importante para a compreensão das propriedades das amidas é o fato de que o par de elétrons livres do nitrogênio amídico encontra-se conjugado com a carbonila amídica:  Assim, a ligação C-N das amidas apresenta um certo caráter de ligação dupla, tornando-a mais forte do que o esperado para uma ligação simples C-N. Isso torna essa ligação mais rígida, diminuindo sua rotação livre e, conseqüentemente, sua flexibilidade conformacional:  Essa característica pode se encontrar tão acentuada que algumas amidas existem preferencialmente em sua forma tautomérica (iminoácido), como no caso dos barbitúricos, fármacos empregados para o tratamento de epilepsia e outros distúrbios do Sistema Nervoso Central:  Também devido a essa conjugação, o nitrogênio amídico não possui propriedades básicas, como ocorre com as aminas, já que esse par de elétrons está delocalizado por ressonância. Na verdade, amidas primárias e secundárias, especialmente as N-arilamidas, podem possuir caráter ácido, já que a desprotonação gera uma base conjugada estabilizada por ressonância. A trifluoroacetanilida, por exemplo, possui um valor de pKa igual a 9,5: 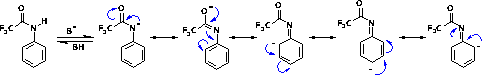
Nomenclatura das aminasA nomenclatura das aminas é feita pela adição do sufixo amina ao nome do radical correspondente à cadeia hidrocarbônica ligada ao átomo de nitrogênio: 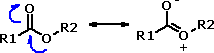 No caso de aminas secundárias e terciárias, o nome dos radicais correspondentes às cadeias hidrocarbônicas de menor tamanho ligadas ao átomo de nitrogênio devem ser colocados antes do nome da amina (em ordem alfabética), adicionando N- para deixar claro que são substituintes do nitrogênio e não da cadeia alquila principal. 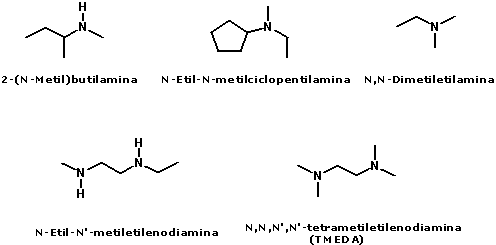 Quando existem, na estrutura do composto, grupos funcionais de maior prioridade para fins de nomenclatura que o grupo amino (íons, ácidos carboxílicos e derivados, aldeídos, cetonas e álcoois), o grupo amino é designado pelo prefixo amino, sempre acrescido do nome dos radicais correspondentes às cadeias hidrocarbônicas ligadas ao átomo de nitrogênio: 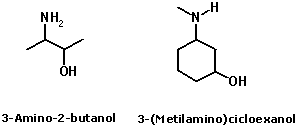 Aminas primárias aromáticas são conhecidas como anilinas, tendo papel histórico fundamental na indústria de corantes. Muitas delas possuem nomes próprios: 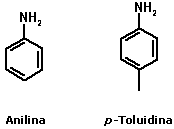 Existem ainda aminas em que o átomo de nitrogênio está inserido em uma estrutura cíclica (anel). Nesse caso, temos aminas heterocíclicas, que na maioria dos casos possuem nomes próprios: 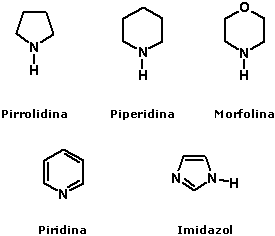 Duas dessas aminas heterocíclicas possuem importância vital para nós: a purina e a pirimidina. Elas fazem parte da estrutura do DNA (ácido desoxirribonucléico), responsável pela transmissão das informações genéticas de pais para filhos. Erros na transmissão desta informação podem levar a doenças congênitas, e alterações na estrutura do DNA (mutações) podem levar ao surgimento de diversos tipos de câncer. 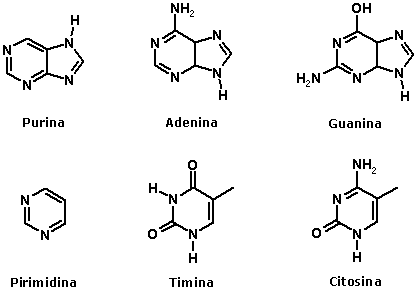 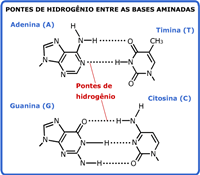 Ligações hidrogênio entre bases nitrogenadas do DNA CLIQUE PARA VER A ANIMAÇÃO 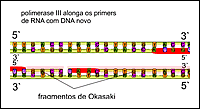 Replicação do DNA CLIQUE PARA VER A ANIMAÇÃO O DNA codifica as informações para a síntese de proteínas, mas para isso ocorrer é necessária a formação de uma fita de RNA (ácido ribonucléico), que é o mediador da conversão da informação presente no DNA em suas unidades operacionais (proteínas). O RNA também serve como material genético para alguns vírus, como o da imunodeficiência humana (HIV), responsável pela AIDS ou SIDA (síndrome da imunodeficiência adquirida). Essa patologia causou a morte de milhares de pessoas no mundo todo e profundas transformações comportamentais. Hoje, muitas instituições atuam na conscientização dos jovens para reduzir as taxas de contaminação por esse vírus.  Órfãos da AIDS na África
Estrutura das aminasTal como ocorre nas amidas, as propriedades físico-químicas das aminas são influenciadas pela sua habilidade de formar ligações hidrogênio. Assim, para aminas com um mesmo número de átomos de carbono, as aminas primárias apresentam maiores valores de ponto de fusão e de ebulição que as secundárias e estas, que as terciárias:
A importância desse efeito pode ser explicitada pela comparação das propriedades das aminas com as das fosfinas e álcoois correspondentes:
As fosfinas, como não formam ligações hidrogênio, possuem menor grau de associação intermolecular; assim, têm menores valores de ponto de fusão e de ebulição. Já os álcoois apresentam valores maiores que as aminas, devido à maior força das ligações hidrogênio, uma vez que a ligação O-H é mais polarizada que a N-H, devido à maior eletronegatividade do átomo de oxigênio. Aminas até seis átomos de carbono são solúveis em água; as aminas primárias e secundárias são menos solúveis que as terciárias de mesmo número de átomos de carbono. A propriedade mais marcante das aminas é sua basicidade. Devido à disponibilidade de um par de elétrons livres, aminas podem se comportar como bases de Lewis, doando esse par de elétrons para espécies ácidas:  A basicidade de uma amina depende do grau de disponibilidade de doação desse par eletrônico. Assim, os efeitos estereoeletrônicos sobre o átomo de nitrogênio influenciam fortemente a basicidade das aminas. Para comparação da força de duas aminas, empregamos normalmente os valores de pKa de seus ácidos conjugados: quanto mais forte for o ácido conjugado de uma amina (menor valor de pKa), menor sua basicidade, já que isso significa que ele não tende a permanecer na forma de ácido conjugado, sofrendo desprotonação e regenerando a base livre. Os efeitos indutivos e de ressonância podem levar a um aumento da densidade eletrônica sobre o átomo de nitrogênio das aminas, e, com isso, aumentar sua basicidade:  Se, por outro lado, diminuem essa densidade, reduzem sua basicidade, já que o par de elétrons estará menos disponível para ser doado:  Compare as formas de ressonância da p-anisidina e da p-nitroanilina:  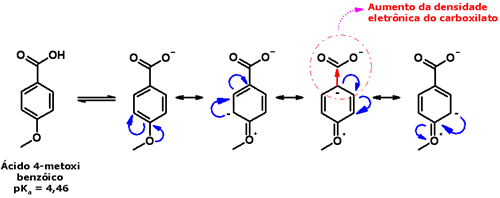 Os efeitos estéricos ao redor do átomo de nitrogênio também influenciam a basicidade, já que a presença de grupos volumosos ao seu redor dificultam a aproximação da espécie ácida, diminuindo assim a capacidade da base de doar seu par de elétrons:
Também são importantes os efeitos de solvatação do ácido conjugado: como são espécies ionizadas, a solvatação por água é importante para sua estabilidade. Como conseqüência, espécies mais hidrofílicas são mais estáveis, ocorrendo competição entre o efeito de solvatação e os efeitos estereoeletrônicos. Ao mesmo tempo, em fase gasosa, quando não ocorre solvatação e as moléculas se encontram isoladas, a ordem de basicidade pode se mostrar alterada, porque agora predominam os efeitos estereoeletrônicos. Dessa forma, a ordem de basicidade para metilaminas em meio aquoso é Me2NH > MeNH2 > Me3N enquanto em fase gasosa a ordem é: Me3N > Me2NH > MeNH2 Aminas possuem, em geral, odor desagradável, nauseante. A putrescina e a cadaverina, formadas pela degradação de aminoácidos durante a decomposição de cadáveres, são bons exemplos. Outra poliamina biogênica é a espermina, presente no sêmen, dando-lhe seu odor característico. Esse nome foi dado a ela porque cristais de fosfato de espermina foram observados no sêmen por Anton van Leeuwenhoek em 1678, embora sua estrutura correta só tenha sido determinada em 1926. 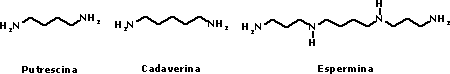
Nomenclatura das nitrilasA nomenclatura oficial das nitrilas é dada com base no nome do hidrocarboneto correspondente, adicionando o sufixo nitrila:  Quando na molécula houver outros grupos funcionais de maior prioridade para nomenclatura (íons, ácidos carboxílicos e derivados, ésteres, amidas), o grupo nitrila será representado no nome do composto pelo prefixo ciano:  Nitrilas têm seus nomes vulgares derivados do ácido carboxílico correspondente, substituindo o sufixo ico pelo sufixo nitrila; por uma questão de sonoridade, inclui-se a letra o entre o radical do nome e esse sufixo: 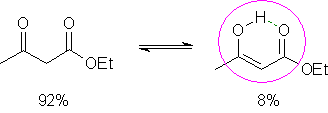 A acrilonitrila é a nitrila derivada do ácido acrílico; é uma matéria-prima importantíssima na indústria de polímeros. Uma das suas aplicações é a síntese da poliacrilonitrila (PAN), um polímero empregado na produção de fibras têxteis que vem sendo estudado para a produção de músculos artificiais, devido à sua propriedade condutora de eletricidade. A acrilonitrila também é empregada na obtenção de um copolímero com butadieno e estireno (ABS), de alta resistência e fundamental para a indústria automotiva.
Estrutura das nitrilasNitrilas apresentam pontos de fusão e ebulição normalmente altos em comparação a outros compostos de massa molecular semelhante, embora não sejam capazes de realizar interações do tipo ligação hidrogênio. Entretanto, devido à alta eletronegatividade do átomo de nitrogênio de hibridização sp das nitrilas, ocorre forte polarização da ligação CºN, possibilitando interações dipolo-dipolo muito fortes entre moléculas de uma determinada nitrila.
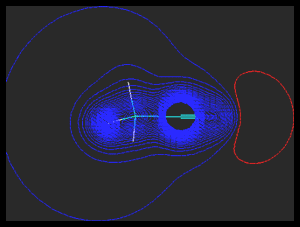 Mapa do potencial eletrostático da acetonitrila As nitrilas de cadeia hidrocarbônica pequena também são bastante solúveis em água, já que pode ocorrer a formação de ligações hidrogênio entre a nitrila e a água: 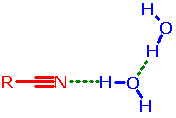 Devido à sua maior eletronegatividade, o átomo de nitrogênio das nitrilas (hibridização sp) é menos básico que o das aminas (hibridização sp3). 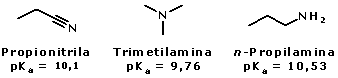
Aminas e nitrilas na naturezaMuitas aminas foram isoladas a partir de fontes naturais, especialmente de plantas. Esses compostos nitrogenados naturais são denominados alcalóides quando apresentam anel heterocíclico nitrogenado e são derivados biossinteticamente de aminoácidos. Vários deles possuem atividades farmacológicas importantes, como a morfina, a cocaína e a pilocarpina. 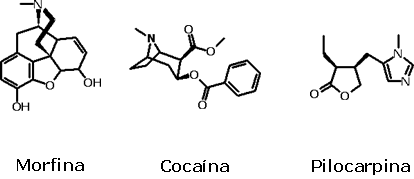 A morfina é um alcalóide presente na semente da papoula (Papaver somniferum), da qual se obtém um exsudato denominado ópio. Tanto o ópio quanto a morfina apresentam forte atividade sedativa, sendo que esta é utilizada clinicamente ainda hoje para o controle de processos envolvendo dores extremas, como pacientes terminais de câncer. Já o ópio tem seu uso proibido, sendo uma das drogas ilegais mais comercializadas em todo o mundo: cerca de 6.600 toneladas/ano em 2006, mais de 90% das quais são produzidos no Afeganistão, segundo dados da UNODC (Escritório das Nações Unidas contra Drogas e Crimes). Acredita-se que esse comércio seja o terceiro mais lucrativo do mundo, superado apenas pela comercialização de petróleo e de armamentos. A importância econômica do ópio pode ser avaliada pela ocorrência de duas guerras entre Inglaterra e China no século XIX, denominadas Guerras do Ópio. A primeira ocorreu entre 1839 e 1842 e a segunda entre 1856 e 1860; elas levaram à abertura dos portos chineses ao comércio ocidental e à cessão da ilha de Hong Kong como colônia inglesa por cem anos. O ópio é utilizado para a preparação da heroína, derivado diacetilado da morfina, que possui maior absorção pelo organismo devido à sua maior lipofilicidade. Tanto a morfina quanto a heroína atuam por ligação e ativação de proteínas denominadas receptores opióides, responsáveis por mediar as atividades de neurotransmissores denominados opióides endógenos, entre os quais estão as endorfinas. Esses neurotransmissores provocam euforia, alívio da sensação de dor e relaxamento, levando a uma sensação de bem-estar. Acredita-se que a liberação de endorfinas está associada também aos efeitos analgésicos da acupuntura, assim como a um estado de bem-estar alcançado por atletas após exercícios físicos extenuantes, denominado runner’s high, mas não há qualquer comprovação científica de que endorfinas estejam associadas a esse estado. Por sua vez, o tratamento de dependência química de opiáceos é realizado empregando agonistas e antagonistas sintéticos desses receptores, a fim de impedir a surgimento de crises de abstinência.
Botão imaturo de
papoula A cocaína é outro alcalóide utilizado como droga de abuso, extraída de folhas de Erythroxylon coca. É a droga de abuso de segundo maior consumo mundial, perdendo apenas para a maconha, embora esteja perdendo terreno para a heroína. Produz euforia intensa, sensação de bem-estar, de poder e ausência de medo; entretanto, seu uso prolongado causa hemorragias, tanto no nariz, local de administração mais comum, como no Sistema Nervoso Central. Pode levar ainda a convulsões, taquicardia, depressão da respiração, coma e morte. Suas ações se dão pelo bloqueio dos sistemas de transporte de aminas biogênicas como a dopamina e a noradrenalina, provocando o aumento de suas concentrações nas fendas sinápticas, aumentando assim a estimulação dos neurônios pós-sinápticos. A história do uso da cocaína tem origem nas populações indígenas andinas há mais de mil anos, e foi muito empregada como analgésico nas sociedades européias até o século XX, quando seu uso foi banido nos EUA. A produção mundial de cocaína é de aproximadamente 910 toneladas por ano (2005); os paises andinos (Colômbia, Peru e Bolívia) são os principais produtores.  Chá de folhas de coca A pilocarpina, por sua vez, é um alcalóide encontrado no jaborandi (Pilocarpus microphyllus), uma rutácea nativa do Brasil cujo nome deriva do tupi yaborã-di, o que quer dizer planta que faz babar. Este alcalóide provoca a redução da pressão do globo ocular, sendo empregado, na forma de colírio, no tratamento do glaucoma. Sua ação se dá pela ativação de receptores colinérgicos muscarínicos presentes na íris, levando a uma redução do volume do humor aquoso e, conseqüentemente, a uma queda na pressão ocular. Também pode ser empregado em portadores de xerostomia, uma condição em que a boca se mantém seca, já que é capaz de ativar as glândulas salivares. O jaborandi também é empregado na formulação de xampus anticaspa e revitalizantes capilares.  Jaborandi A presença de nitrilas na natureza é bem menos profícua que a das aminas; são normalmente encontradas na forma de cianoidrinas, que são produtos de condensação entre compostos carbonilados (aldeídos e cetonas) e íons cianeto:  Uma cianoidrina muito conhecida é a mandelonitrila, derivada do benzaldeído, que é liberada pelo milípode Apheloria corrugata como mecanismo de defesa, sendo hidrolisada no momento da agressão, formando benzaldeído e ácido cianídrico. Existem também alguns glicosídeos cianogênicos (geradores de HCN), como a amigdalina, presente nas amêndoas amargas. A linamarina é um glicosídeo cianogênico encontrado no aipim (mandioca), e por isso este deve ser bem cozido antes de ser ingerido para que ocorra a decomposição desse cianeto, tornando seguro, assim, o seu consumo. Estima-se que aproximadamente 2.500 espécies vegetais produzam glicosídeos cianogênicos como mecanismo de defesa; por isso, é comum acontecer envenenamento do gado e de pessoas pela ingestão de certas plantas tóxicas ou de água na qual raízes de aipim foram deixadas de molho.  Aipim
Este site foi atualizado em 16/01/11 |