PROFESSOR
PAULO CESAR
|
PROFESSOR PAULO CESAR |
|
|
|
|
|
A Química na cozinha apresenta: O VINAGRE
Introdução
Nesta figura, três grandes mestres da China provam o vinagre de um jarro, e cada um tem uma reação diferente. O vinagre aqui representa a Essência da Vida. O primeiro deles, Confúcio, tem uma expressão austera, já que ele acreditava que a vida presente dos homens na Terra se encontrava em desarmonia com o passado e com o Caminho dos Céus. O segundo deles, Buda, tem uma expressão amarga, pois para ele a vida era amarga por causa dos desejos que levam ao sofrimento, e o mundo era um lugar cheio de armadilhas, ilusões e dor. Já o terceiro personagem, Lao Zi, autor do mais antigo livro do Taoísmo, sorri, pois para ele a harmonia natural existente entre Céu e Terra pode ser encontrada por todos a qualquer momento, sendo a Terra um reflexo do Céu e regida pelas mesmas regras. O mundo, para ele, não é um local de armadilhas, mas um professor de lições valiosas. O vinagre é um produto muito utilizado na culinária do mundo inteiro. Seu nome deriva do termo francês vin aigre, ou seja, vinho azedo. E ele é azedo por causa da presença de ácido acético, que é um produto da oxidação do etanol presente no vinho. Embora o vinagre mais conhecido entre nós seja o de vinho (tinto ou branco), qualquer bebida alcoólica pode fornecer vinagre. Assim, há vinagres de arroz, de cidra, de mel e do próprio etanol. O produto mais consumido, na verdade, é o chamado agrin, que é formado por 90% de fermentado de etanol e 10% de fermentado de vinho. Há ainda os vinagres aromatizados, em que se adicionam ervas aromáticas ou frutas ao vinagre, deixando-o em maceração por alguns dias. São excelentes para temperar saladas e preparar alguns pratos saborosos.  Há ainda o chamado vinagre balsâmico (aceto balsamico), que é um vinagre de sabor agridoce, escuro e de odor bem acentuado. É produzido a partir de uvas bem maduras, mais doces, que depois de secas são prensadas para obter o suco que será fermentado, após evaporação de parte da água presente, em barris de madeira. O vinagre balsâmico original é produzido com uvas da região de Módena (Itália), e deve ser maturado por, no mínimo, dez anos!  Você mesmo pode preparar um vinagre balsâmico caseiro... aliás, por que não preparar vinagres aromatizados e vinagre balsâmico artesanais? Além disso, devido ao seu poder conservante, o vinagre é utilizado na preparação de conservas de legumes (cenoura, beringela, picles), frutas (como o chutney de manga, famoso na culinária indiana), ovos e peixes, que você mesmo ou seus alunos podem fazer. Com um pouco de imaginação e bom gosto, vocês podem até gerar uma renda extra! Você já deve ter reparado que, ao deixar uma garrafa de vinho aberta por muito tempo, ele se torna amargo, ou seja, se transforma em vinagre. O que acontece no vinho para que ocorra essa transformação?
Fermentação alcoólica e fermentação acéticaO etanol é o principal produto de fermentação da glicose, servindo não só para uso recreacional, nas chamadas bebidas alcoólicas, mas também como matéria-prima fundamental da indústria de transformações químicas, material de uso hospitalar e como biocombustível.  Planta de produção de etanol A fermentação é um processo anaeróbico de produção de energia realizado por diversos microorganismos. No caso da fermentação alcoólica, a glicose é convertida em piruvato na glicólise:  Em seguida, o piruvato é descarboxilado, formando acetaldeído, que é reduzido pelo NADH, gerando etanol: 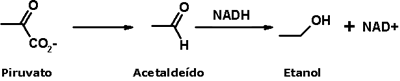 Esse processo gera o etanol presente em bebidas alcoólicas como o vinho e a cerveja. Esse mesmo etanol é convertido, por bactérias dos gêneros Acetobacter e Gluconobacter, em ácido acético, num processo aeróbico (na presença de O2, como depois de abrir a garrafa de vinho):   Barril para produção de vinagre Outro processo de fermentação muito conhecido é o da fermentação láctica, que leva à produção de iogurte. Nesse processo anaeróbico, o ácido pirúvico é reduzido pelo NADH em ácido lático: 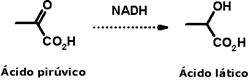  CLIQUE PARA VER A ANIMAÇÃO Você pode preparar iogurte em casa ou com seus alunos; a receita é simples e é um bom ponto de partida para discutir ácidos carboxílicos! Agora, será que o ácido acético só serve para fazer vinagre?
Ácido acéticoO ácido acético, além de seu uso culinário, é muito utilizado como matéria-prima na indústria química. Quando está isento de água, é denominado ácido acético glacial, por se solidificar a baixas temperaturas (seu ponto de fusão é de 16,5 oC), formando cristais brilhantes e transparentes como o gelo. O uso industrial do ácido acético inclui a produção de polímeros como o PET (politereftalato de etila), usado na fabricação de garrafas de refrigerante, como o PVA (poliacetato de vinila), empregado como cola de madeira, e na obtenção de acetato de celulose (produção de películas fotográficas) e de diversos solventes orgânicos, como o acetato de etila e o acetato de isoamila (óleo de banana). Além disso, é usado como solvente em inúmeros processos de síntese orgânica, por ser um solvente polar prótico, estabilizando espécies catiônicas como os íons carbênio (carbocátions, espécies reativas cujo estudo rendeu o Premio Nobel de Química a George Olah em 1994). O consumo mundial de ácido acético é estimado em 6,5 milhões de toneladas por ano.  Garrafas PET  Poliacetato de vinila (PVA) O ácido acético é um ácido considerado relativamente forte dentro da Química Orgânica (pKa = 4,75), embora possa ser considerado fraco em comparação com ácidos inorgânicos como o HCl (pKa = -7,0). Sua acidez, como a dos demais ácidos carboxílicos, se deve à estabilização da base conjugada (íon acetato) por ressonância, ou seja, pela distribuição do par eletrônico (oriundo da quebra da ligação O-H) entre os dois átomos de oxigênio do grupamento carboxilato:  Isso explica por que os ácidos carboxílicos são ácidos mais fortes que os fenóis e que os álcoois. No caso dos fenóis, apesar do maior número de formas de ressonância, em três delas a carga negativa se localiza em um átomo de menor eletronegatividade que o oxigênio: 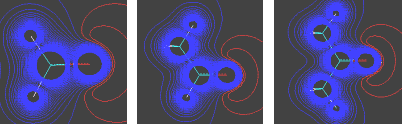 Já nos álcoois, não ocorre delocalização da carga, o que faz com que esta permaneça concentrada no átomo de oxigênio: 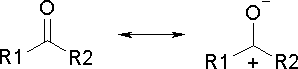 Os derivados halogenados de ácidos carboxílicos também possuem muitas aplicações em síntese orgânica. O ácido monocloroacético, por exemplo, é empregado na síntese de inseticidas e do corante índigo. O uso desses compostos deve se realizado com extrema cautela, pois são muito corrosivos. 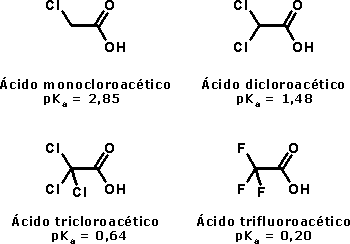 Esses ácidos, como você pode ver, possuem maior acidez que o ácido acético, o que implica dizer que suas bases conjugadas são mais estabilizadas que o íon acetato. Isso ocorre devido ao efeito indutivo de atração de elétrons (I-) dos átomos de halogênios, que delocalizam a carga concentrada no grupo carboxilato. 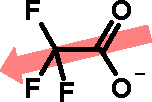 A seta em vermelho representa o vetor do momento de dipolo Por sua vez, o ácido piválico, em que o grupamento metila do ácido acético foi substituído pelo grupamento t-butila, apresenta pKa = 5,03. A menor acidez desse ácido pode ser atribuída ao efeito indutivo doador de elétrons (I+) dos grupamentos metila, o que aumenta a densidade eletrônica no íon carboxilato, diminuindo sua estabilidade: 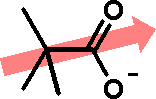 A seta em vermelho representa o vetor do momento de dipolo Lembre-se de que o efeito estérico do grupamento t-butila também contribui para a menor acidez, por dificultar a aproximação da espécie básica que abstrai o átomo de hidrogênio ácido. Outros derivados importantes do ácido acético são o ácido glicólico e o ácido tioglicólico: 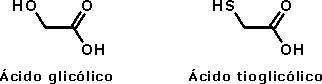 O ácido glicólico é um α-hidroxiácido, empregado em produtos cosméticos para peeling devido à sua alta penetrabilidade cutânea, melhorando a aparência e a textura da pele. O ácido tioglicólico é empregado como depilador químico e também em permanentes, por romper as pontes dissulfeto presentes nas proteínas do cabelo, permitindo o alisamento do fio. Como é comum entre todos os compostos que apresentam grupo tiol (SH), ele possui um odor forte e desagradável. Este é um ótimo exemplo de como a química está diretamente relacionada ao nosso dia-a-dia!
Nomenclatura oficial dos ácidos carboxílicosA nomenclatura oficial (IUPAC) dos ácidos carboxílicos é dada a partir da nomenclatura do hidrocarboneto de mesmo número de átomos de carbono que o ácido em questão. Assim, o ácido carboxílico de dois carbonos tem seu nome derivado do etano, ao qual se agregam a palavra ácido e o sufixo ico. No caso de cicloalcanos, agrega-se o sufixo carboxílico. Assim, o ácido carboxílico de dois carbonos será o ácido etanóico. 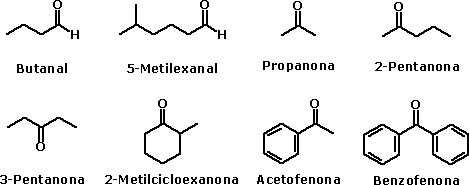 Veja outros exemplos:  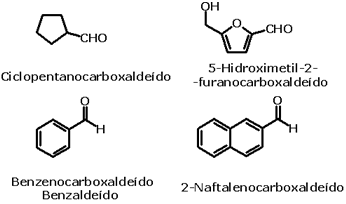 Há também ácidos dicarboxílicos, e sua nomenclatura é feita da mesma forma, porém agregando o sufixo dióico. 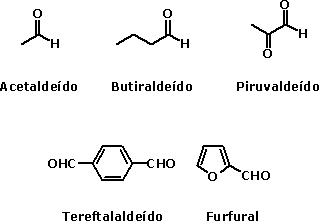 O ácido carboxílico derivado da oxidação do tolueno é o ácido benzóico. Os ácidos carboxílicos aromáticos também têm seu nome derivado do hidrocarboneto correspondente: 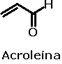
Nomenclatura comum dos ácidos carboxílicosAlém da nomenclatura oficial, os ácidos carboxílicos apresentam nomes vulgares relacionados a produtos ou organismos onde eles são encontrados:  Ácido fórmico (do latim formica, formiga) 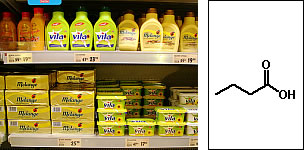 Ácido butírico (do latim butyrum, manteiga)  Ácido propiônico (do grego pro pion, primeira gordura) 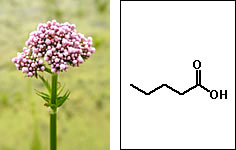 Ácido valérico (obtido de Valeriana officinalis L.)  Ácido oxálico (obtido de plantas do gênero Oxalis)  Ácido lático (obtido da fermentação da lactose presente no leite)  Ácido málico (obtido da maça e da pêra) 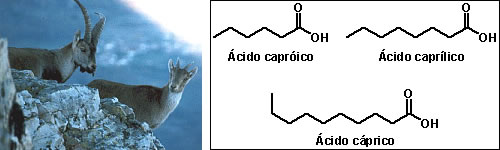 Ácidos capróico, caprílico e cáprico (obtidos da pele de caprinos) 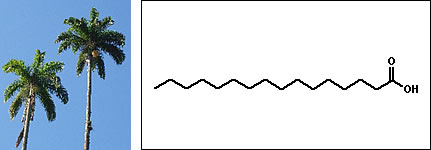 Ácido palmítico (obtido do óleo de palmeira) 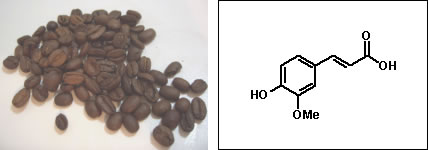 Ácido caféico (obtido do café)  Ácido siríngico (obtido do lilás (Syringa sp.))  Ácido cítrico (obtido de frutas do gênero Citrus) Essa grande variedade de fontes naturais mostra a ampla distribuição dos ácidos carboxílicos na natureza, sua importância econômica e para a manutenção dos sistemas biológicos.
Estrutura e propriedades físico-químicas dos ácidos carboxílicosOs ácidos carboxílicos possuem propriedades físico-químicas determinadas, principalmente, pela capacidade que o grupamento carboxila tem de atuar tanto como doador como aceptor de hidrogênio em ligações hidrogênio:  Assim, mesmo em fase gasosa, é comum observar moléculas de ácidos carboxílicos formando dímeros: 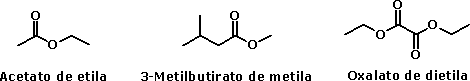 A formação de fortes interações intermoleculares do tipo ligação hidrogênio também faz com que os ácidos carboxílicos possuam pontos de fusão e de ebulição maiores que os álcoois de mesmo tamanho de cadeia:
A formação de ligação hidrogênio intramolecular leva à redução dos valores dessas propriedades físicas, porque diminui o grau de interação intermolecular, como acontece no ácido salicílico: 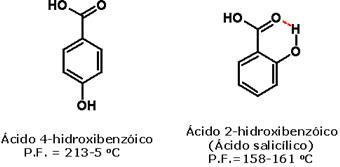 A acidez dos ácidos carboxílicos é determinada também por seu padrão estrutural. Como você viu no caso do ácido acético e de seus derivados, os efeitos indutivos e estéricos desempenham papel importante na determinação dos valores de pKa. Outro efeito eletrônico importante é o efeito de ressonância, que influencia a acidez de ácidos carboxílicos aromáticos, como o ácido benzóico. Assim, grupos que doam elétrons para o anel aromático por ressonância (por exemplo, metoxila, cloro, bromo, iodo, hidroxila, amino) tendem a diminuir a acidez desses compostos, porque aumentam a densidade eletrônica do carboxilato, diminuindo assim a estabilidade da base conjugada: 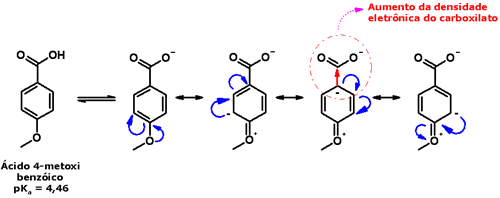 Por sua vez, grupos que retiram elétrons do anel aromático por ressonância (como nitro, ciano, carbonila) aumentam a acidez, por diminuírem a densidade eletrônica do carboxilato, estabilizando assim a base conjugada: 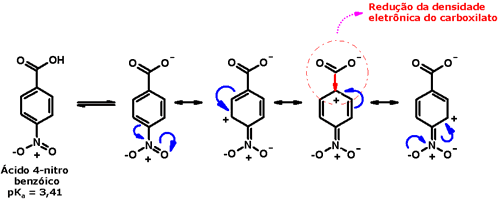
Derivados de ácidos carboxílicosOs ácidos carboxílicos podem ser convertidos em diversos derivados importantes, como os ésteres e as amidas. Entretanto, para a síntese desses compostos, os ácidos carboxílicos precisam ser convertidos em derivados de maior reatividade, como os haletos de ácidos e os anidridos: 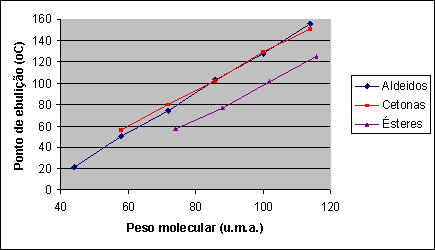 Os haletos de ácidos mais comuns são os cloretos de ácido, por serem os de menor custo e maior estabilidade química. A nomenclatura de um cloreto de ácido é dada a partir do nome do ácido carboxílico correspondente, usando o termo cloreto de acrescido do nome correspondente ao ácido, porém substituindo o sufixo ICO pelo sufixo ILA: 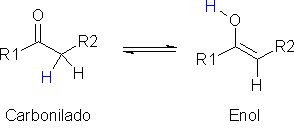 Os anidridos são produtos de desidratação formados na combinação de duas moléculas de um ácido carboxílico: 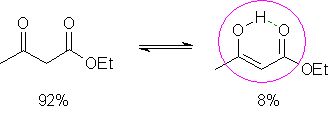 Sua nomenclatura é feita substituindo a palavra ácido por anidrido no nome do ácido correspondente: 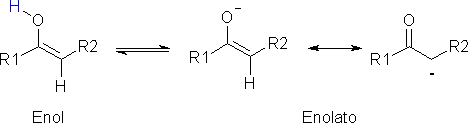 Existem também anidridos mistos, formados pela combinação de dois diferentes ácidos carboxílicos. Nesse caso, o nome do anidrido deve incluir o nome dos dois ácidos que lhe deram origem, em ordem alfabética: 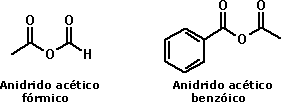
Sabões e detergentes - estrutura e propriedadesUma aplicação muito importante dos ácidos carboxílicos é na fabricação dos sabões. Mas o que é um sabão? Sabões são sais de ácidos carboxílicos de cadeia longa (os chamados ácidos graxos). Esses sais possuem caráter misto, em termos de solubilidade em água: por possuírem cadeia hidrocarbônica longa, esta tende a ser insolúvel em água mas capaz de interagir com espécies apolares, como gorduras e outras que denominamos comumente sujeira. Por outro lado, possuem também uma região polar, que é o grupamento ácido carboxílico ionizado (carboxilato), capaz de interagir com moléculas de água. Assim, as moléculas de sabão podem interagir tanto com água como com gorduras, levando à dispersão destas naquele solvente, ou seja, proporcionando aquilo que chamamos limpeza.  Sabão de coco e sabão em pó Os sabões, uma vez em solução aquosa, formam as chamadas micelas. Micelas são estruturas em que várias moléculas de sabão se agregam, formando uma estrutura esférica. No interior dessa esfera se localizam as cadeias hidrocarbônicas do sabão, juntamente com as gorduras, interagindo entre si através de interações de van der Waals; por outro lado, os grupos carboxilato ficam na superfície da micela, voltados para o solvente (água), e interagindo com este através de interações do tipo ligação de hidrogênio e íon-dipolo. A formação da micela minimiza a repulsão entre as cadeias hidrocarbônicas e as moléculas de água e permite a dispersão da gordura no ambiente aquoso. Entretanto, as micelas só se formam a partir de uma determinada concentração de sabão em água, a chamada concentração micelar crítica (CMC). Abaixo dela, as moléculas de sabão encontram-se isoladas no meio aquoso. 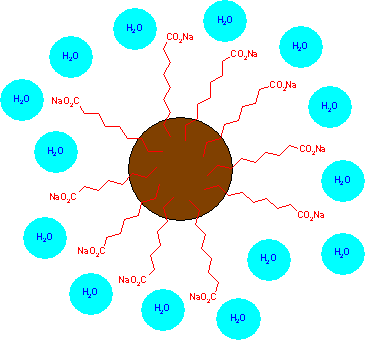 Esquema de uma micela Os sabões são preparados por hidrólise de triglicerídeos com bases como o hidróxido de sódio ou de potássio. Triglicerídeos são ésteres de ácidos graxos com glicerol, e a hidrólise em meio alcalino gera sabão (sal de ácido graxo) e glicerina (glicerol). Os triglicerídeos empregados são de origem animal ou vegetal, podendo ser denominados óleos (quando líquidos) ou gorduras (quando sólidos). Assim, o sabão de coco, por exemplo, vem da hidrólise da gordura de coco. O uso de hidróxido de sódio gera sabões sólidos, enquanto o hidróxido de potássio fornece sabões pastosos.  Óleo e sabão de buriti  Gordura e sabão de cupuaçu E os sabonetes? Sabonetes são sabões que tiveram seu pH ajustado ao pH da pele, para não agredi-la, aos quais se adicionam perfume, corante e outros aditivos, como creme hidratante ou glicerina. Atualmente, fazer sabonetes artesanais é uma atividade que pode reforçar o orçamento doméstico, e os materiais necessários podem ser encontrados em diversas lojas especializadas. Esta pode ser uma atividade didática para você fazer com seus alunos e inserir a Química no cotidiano deles!  Sabonete Você já lavou sua mão com sabão depois de escrever no quadro-negro com giz? Se usou realmente sabão, deve ter notado que não ocorreu formação de espuma. Mas se tiver utilizado detergente, aí sim, formou espuma e sua mão deve ter ficado livre dos resíduos de giz. Qual a diferença entre sabão e detergente, então? Enquanto sabões são sais de ácidos carboxílicos, detergentes são sais de ácidos sulfônicos. Enquanto os sais de ácidos carboxílicos com íons divalentes e trivalentes (Ca2+ e Fe3+, por exemplo) são insolúveis em água, os sais de ácidos sulfônicos desses mesmos íons são solúveis. Assim, os detergentes são capazes de produzir espuma mesmo empregando-se águas duras, isto é, águas ricas em íons metálicos como cálcio, magnésio e ferro.  Detergente líquido Os detergentes, ao contrário dos sabões, são de origem sintética. Muitos detergentes causam problemas ambientais, ao serem lançados em cursos de rios, levando à formação de espumas; assim, é importante haver tratamento de resíduos de indústrias, de forma a diminuir a degradação do meio ambiente. Também é importante o uso de detergentes biodegradáveis, que são sais de alquilbenzenosulfonatos lineares. Os microorganismos presentes no ambiente são capazes de oxidar essas cadeias lineares, ou seja, promovem a biodegradação desses detergentes, enquanto os de cadeia ramificada não são oxidados, permanecendo no ambiente e contaminando-o. Sabões e detergentes são denominados tensoativos aniônicos, porque em ambos o grupo polar é um ânion (carboxilato ou sulfonato). Existem outros tipos de tensoativos: os catiônicos, que possuem como grupo polar um nitrogênio quaternário (sal de amônio quaternário), os anfóteros ou betaínicos, que possuem dois grupos ionizados – um aniônico e outro catiônico –, e os não-iônicos, que são poliálcoois, como os polietilenoglicóis (PEG). Detergentes e outros tensoativos também são empregados na formulação de produtos de higiene. Os xampus, por exemplo, são soluções de alquilsulfonatos e alquilsulfatos, como o laurilsulfato de sódio; os xampus infantis empregam tensoativos anfóteros, porque estes não irritam a mucosa ocular (“não arde o olho”, como dizia uma propaganda desse tipo de produto). Os condicionadores empregam tensoativos catiônicos, que interagem com os grupamentos aniônicos presentes na proteína do cabelo (queratina), levando, assim, a um efeito antiestático, facilitando o penteado. Materiais para preparação de xampus e condicionadores também podem ser encontrados facilmente em lojas especializadas.  Xampu infantil
Propriedades de sabões e detergentesSabões são sais de ácidos graxos, obtidos a partir de óleos e gorduras de origem natural. Por possuir uma cadeia hidrofóbica e um grupo carboxilato ionizado, eles são capazes de interagir tanto com gorduras como com a água, levando à remoção desses materiais graxos. Observe algumas propriedades dos sabões enquanto realiza estas atividades práticas:
Este site foi atualizado em 16/01/11 |