









































































































|
|
|

Um dia, os Romanos perceberam
que, quando a
gordura
do animal escorria até as
cinzas
da madeira queimada,
formava-se uma pasta ótima para
lavar roupas.
Era o sabão.
Mas como age o sabão no
processo de limpeza?
O
Portal de Estudos em
Química desvendará esse
mistério e muitos mais!
Um pouco de
história
|
As referências mais antigas aos sabões
remontam ao início da Era cristã.
O
sábio romano Plínio
(foto ao lado) o Velho (Gaius
Plinius Secundus,
23 ou
24-79 d.C),
autor da célebre História Natural, menciona a
preparação do sabão a partir do cozimento do
sebo de carneiro com cinzas de madeira.
De acordo com sua descrição, o procedimento envolve
o tratamento repetido da pasta resultante com sal,
até o produto final. Segundo Plínio,
os fenícios conheciam a técnica desde 600 a.C.
O médico grego Galeno (130-200 d. C), que fez
carreira, fama e fortuna em Roma, também descreve
uma técnica segundo a qual o sabão podia ser
preparado com gorduras e cinzas, apontando sua
utilidade como medicamento para a
remoção de sujeira
corporal e de tecidos mortos da pele. O alquimista
árabe Geber (Jabir Ibn Hayyan), em escrito do século
VIII da Era Cristã, também menciona o sabão como
agente de limpeza.
No século XIII, a indústria de sabão foi
introduzida na França, procedente da Itália e da
Alemanha. No século XIV, passou a se estabelecer na
Inglaterra. Na América do Norte o sabão era
fabricado artesanalmente até o século XIX. A partir
daí surgem as primeiras fábricas. No Brasil, a
indústria de sabões data da segunda metade do século
XIX. |
 |
Dois grandes avanços
químicos marcam a revolução na produção de sabões. Em 1791,
Nicolas Leblanc (1742-1806) concluiu o desenvolvimento do método
de síntese da barrilha (carbonato de sódio) a partir da salmoura
(solução de cloreto de sódio). Michel Eugéne Chevreul
(1786-1889), entre 1813 e 1823, esclareceu a composição química
das gorduras naturais. Assim, os fabricantes do século XIX
puderam ter uma idéia do processo químico envolvido,
bem como dispor de matéria-prima necessária.
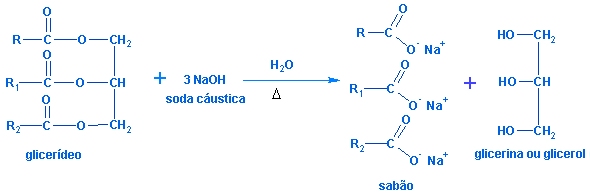
Reação de
produção do sabão
Atualmente, o sabão é
obtido de
gorduras
(de boi, de porco, de
carneiro, etc) ou de
óleos (de algodão, de
vários tipo de palmeiras, etc.). A
hidrólise alcalina
de glicerídeos é
denominada, genericamente, de reação de saponificação porque,
numa reação desse tipo, quando é utilizado um éster proveniente
de um ácido graxo, o sal formado recebe o nome de sabão.
A equação abaixo
representa genericamente a hidrólise alcalina de um óleo ou de
uma gordura:
|
O ácido graxo será então
neutralizado por:
> NaOH ou Na2CO3,
dando R — COONa (sabões de sódio, em geral mais
duros);
> KOH ou K2CO3,
dando R — COOK (sabões de potássio, mais moles e
usados, por exemplo, em cremes de barbear);
> Hidróxidos de
etanolamina, como, por exemplo, (OH-CH2-CH2)3NHOH,
dando R — COONH(CH2-CH2-OH)3
(sabões de amônio, que são em geral líquidos usados,
por exemplo, em xampus).
O mais comum
de todos é o sabão de sódio. O que é praticamente
neutro, que contém glicerina, óleos, perfumes e
corantes, é o
sabonete.
Como o sabão limpa?
Tensão superficial da água
Certos insetos
conseguem
caminhar sobre a superfície da água,
que se comporta como uma película tensa e elástica,
apenas deformada nos pontos onde apoiam-se as patas
do inseto. Essa propriedade dos líquidos, chamada de
tensão superficial,
ocorre devido às forças de atração que as moléculas
internas do líquido exercem sobre às da superfície.
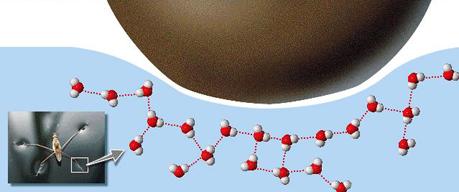
As moléculas
situadas no interior de um líquido são atraídas em
todas as direções pelas moléculas vizinhas e, por
isso, a resultante das forças que atuam sobre cada
molécula é praticamente nula. As
moléculas da superfície do líquido, entretanto,
sofrem apenas atração lateral e inferior.
Esta força para o lado e para baixo cria a tensão na
superfície, que faz a mesma comportar-se como uma
película elástica. |
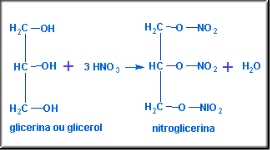
Falando um pouco sobre a glicerina
A
glicerina (ou glicerol) é um subproduto da
fabricação do sabão. Por esse motivo, toda fábrica
de sabão também vende glicerina. Ela é adicionada
aos cremes de beleza e sabonetes, pois é um bom
umectante, isto é, mantém a umidade da pele. Em
produtos alimentícios ela também é adicionada com a
finalidade de manter a umidade do produto e aparece
no rótulo com o código "umectante U.I".
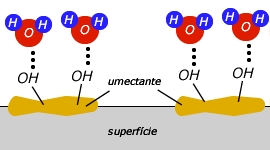
Os
umectantes, como por exemplo a glicerina, interagem
com a superfície do material que se deseja umectar
(pele, cabelo, produto alimentício) e também com a
água. A interação com a água ocorre por meio de
pontes de hidrogênio (representadas pelos
pontilhados na imagem acima).
Outra
utilidade da glicerina é na fabricação do explosivo
conhecido como nitroglicerina.
 |
A
tensão superficial está presente em situações
interessantes:
> Colocando-se cuidadosamente uma
pequena agulha sobre a superfície da água,
observa-se que ela pode permanecer sobre a
película superficial sem afundar no líquido,
apesar de ser muito mais densa que a água.
> A gota de água que se forma numa
torneira mantém sua forma devido a elasticidade
na superfície da gota.
> Num copo cheio de água, podemos
acrescentar pequenos objetos sem que a água
transborde. Isto ocorre porque a superfície da
água comporta-se elasticamente.
Todas essas
propriedades são decorrentes da interações
inter-moleculares
existentes na água, as quais são do tipo "ponte
de hidrogênio".
|
 |
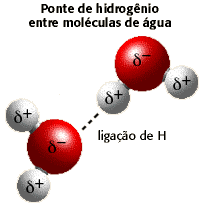
Essas
ligações inter-moleculares existentes na água são responsáveis
por diversas de suas propriedades, inclusive é a
justificativa da água ser
"líquida", fato esse
que não ocorre com os hidretos dos outros elementos da família
do oxigênio. O Naeq já publicou um artigo sobre o assunto
intitulado: "Ponte
de hidrogênio, força molecular intrigante!.
Como atua o
sabão?
A água, por si só, não
consegue remover certos tipos de sujeira, como, por exemplo,
restos de óleo. Isso acontece porque
as moléculas
de água são polares e as de óleo, apolares.
O sabão exerce um papel importantíssimo na limpeza porque
consegue, por assim dizer, "jogar nos dois times" ou, com sugere
o título deste trabalho, possui dupla "personalidade", no que
diz respeito a sua polaridade.
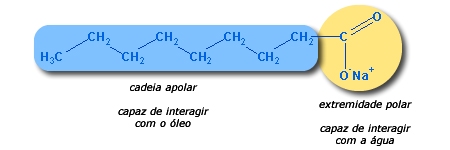
Podemos dizer que a cadeia apolar
de um sabão é hidrofóbica
(possui aversão pela água, a
repele) e que a extremidade polar é
hidrófila
(possui afinidade pela água, a
atrae).
Dessa maneira, ao lavarmos
um prato sujo de óleo, formam-se o que os químicos chamam de
micelas,
gotículas microscópicas de gordura envolvidas por moléculas de
sabão, orientadas com a cadeia apolar direcionada para dentro
(interagindo com o óleo) e a extremidade polar para fora
(interagindo com a água).
Vejamos agora como o sabão
atua no processo de limpeza de gordura:
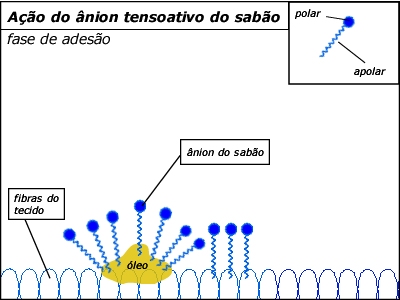
Diminuem a tensão superficial da
água, de modo que esta
possa "molhar melhor" os materiais
(daí os sabões serem chamados de
substâncias tensoativas, ou seja, substâncias que
abaixam a
tensão superficial de um líquido).
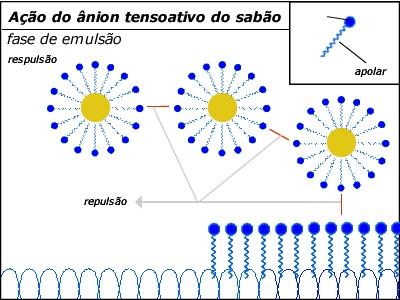
Concentram-se as partículas de
óleo ou gordura em micelas coloidais,
que
se mantêm dispersas na água (daí
os sabões serem chamados
de substâncias
emulsificantes ou surfactantes).
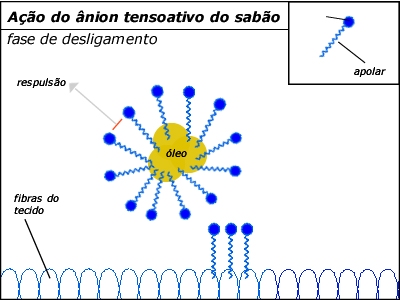
Impedem a reaglomeração das
micelas, que ficam protegidas por uma
película e se afastam por
repulsão de cargas elétricas.
O que fazer
quando o sabão falha?
O sabão tem, sobre os
detergentes, as seguintes vantagens: é mais barato, atóxico,
fabricado a partir de matérias-primas renováveis (óleos e
gorduras) e
biodegradável, ou
seja, consumido e destruído pelos microorganismos existentes na
água que, desse modo, não fica poluída. O sabão apresenta
problemas em dois casos:
> quando a água utilizada tem
caráter ácido,
pois:
R — COONa+ H+
—> R—COOH + Na+
ácido graxo
Essa reação libera o ácido graxo,
que forma a gordura observada em tanques, pias e banheiras.
>
quando a água usada é dura,
isto é, contém cátions metálicos, especialmente Ca2+
e Mg2+, pois
2R — COONa + Ca2+ --->
(R—COO)2Ca(ppt)
+ 2Na+
precipitado
Os sais de cálcio e/ou magnésio dos
ácidos graxos
são insolúveis e
formam crostas nos tanques, pias e banheiras.
Entre em
cena, os detergentes
Os detergentes são
produtos sintéticos, resultantes da indústria petroquímica. Eles
começaram a ser usados intensamente a partir da Segunda Guerra
Mundial, quando houve escassez de óleos e gorduras para a
fabricação de sabão comum.
Os mais comuns são
sais de sódio de
sulfatos de alquilas
de cadeia longa ou de
ácidos sulfônicos
também de cadeia longa; por exemplo:
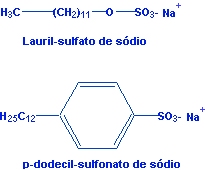
Esse tipo de detergente é
chamado de
detergente aniônico,
devido a parte orgânica estar situada no ânion do composto. Já
quando a parte orgânica da molécula está no cátion, denominamos
de detergente
catiônico (veja
exemplo abaixo).
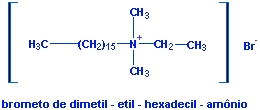
|
Porém, essa história não é feita somente
de vantagens para com os detergentes. Eles têm
alguns entretantos...
Até alguns anos atrás, os detergentes eram
fabricados com compostos orgânicos de
cadeia
ramificada,
como por exemplo:.
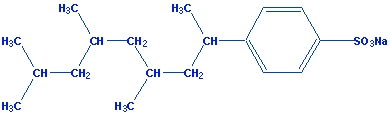
Essas substâncias
não são
biodegradáveis,
isto é, não são consumidas pelos microorganismos
existentes na água, causando o aparecimento de
espumas, inviabilizando a vida de outras espécies na
água devido ao
impedimento da
entrada de oxigênio
na água. |
Normalmente os
detergentes vendidos no comércio possuem a seguinte
composição
> o detergente
propriamente dito.
> Fosfatos,
como por exemplo, o trifosfato de sódio (Na5P3O10),
que agem:
> como substância
básica, neutralizando a eventual acidez da água e
ainda ajudando na ação da limpeza.
> reagindo com os
cátions Ca2+ e Mg2+, que
existem em possíveis águas duras.
> outras
substâncias
> bórax (Na2B4O7
. 10 H2O), para tirar odores.
> descorantes
(como NaClO), para tirar manchas
> enzimas,
para eliminar manchas de proteínas, como manteiga,
ovos, etc.
> anticorrosivos
das máquinas de lavar roupa (como Na2SiO3).
> perfume
> corantes
fluorescentes(ou também denominados de
branqueadores ópticos), que em geral absorvem a luz
ultravioleta, emitindo uma luz azulada que disfarça
o amarelado das roupas, dando "o branco mais
branco". Note que essa substância não elimina, mas
apenas "camufla" a sujeira. |
Posteriormente,
passaram-se a usar detergentes biodegradáveis, que não
apresentam esses inconvenientes e são formados por compostos
orgânicos de
cadeia linear,
ou seja, sem
ramificações o que possibilita que os organismos façam a
degradação dessas substâncias.
Outro problema é causado
pelos fosfatos
existentes na formulação dos detergentes. Como sabemos, os
fosfatos são adubos ou fertilizantes das plantas e, quando
atingem as águas dos rios e lagos, acabam provocando um
crescimento exagerado
de certas algas e plantas aquáticas (eutroficação),
que consomem boa parte do oxigênio da água. Isso acaba por
impedir a existência de outras formas de vida, inclusive a dos
peixes. Atualmente, os fosfatos estão sendo substituídos, ao
menos em parte, por carbonato de sódio, silicato de sódio,
citrato de sódio e outras substâncias menos nocivas.
|
 Todos
nós já brincamos com bolhas de sabão. E
elas nos acompanham por toda a vida:
escovando os dentes, no banho, lavando o
automóvel, no colarinho da cerveja... Todos
nós já brincamos com bolhas de sabão. E
elas nos acompanham por toda a vida:
escovando os dentes, no banho, lavando o
automóvel, no colarinho da cerveja...
Do que as bolhas
são feitas? Portal de Estudos em
Química (PEQ) apresenta o artigo do
professor Nito Debacher, do departamento
de Química da UFSC.
|
Bolhas de sabão e
detergentes
Prof. Nito A.
Debacher
O estudo das formas das bolhas e dos filmes de
sabão ou detergente é uma área que tem fascinado
muitos cientistas e a primeira monografia escrita
sobre este assunto foi em 1890 por C.V. Boys.
|
O que são sabões ou detergentes
|
Os sabões são formados a partir de
ácidos graxos extraídos de gorduras animais
ou vegetais e saponificados pela soda
caustica (NaOH) ou pela potassa caustica (KOH)
formando o sal correspondente.
Os detergentes mais comuns são
formados por moléculas de ácido sulfônico
que reagindo com a soda caustica forma o
sulfonato de sódio.
Estas moléculas são também chamadas de
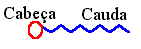 surfactantes
(surface active agents) e possuem
duas regiões distintas: uma parte polar
chamada de cabeça e uma parte apolar
formada por hidrocarbonetos, chamada
de cauda.Quando em meio aquoso, estas
moléculas interagem tanto com a água que é
polar e com o ar ou gorduras que são
apolares. surfactantes
(surface active agents) e possuem
duas regiões distintas: uma parte polar
chamada de cabeça e uma parte apolar
formada por hidrocarbonetos, chamada
de cauda.Quando em meio aquoso, estas
moléculas interagem tanto com a água que é
polar e com o ar ou gorduras que são
apolares.
Como se organizam em água
Naturalmente, se colocarmos moléculas desta
natureza na água, podemos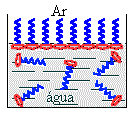 imaginar que elas se sentirão mais
"confortáveis" se ficarem na superfície de
maneira a satisfazer as suas características
da seguinte forma; uma parte imersa em
contato com a água e outra parte direcionada
para o ar. Deste modo, teremos
preferencialmente a formação de uma camada
superficial de moléculas colocadas em fila
única até cobrir toda a superfície do
recipiente.
imaginar que elas se sentirão mais
"confortáveis" se ficarem na superfície de
maneira a satisfazer as suas características
da seguinte forma; uma parte imersa em
contato com a água e outra parte direcionada
para o ar. Deste modo, teremos
preferencialmente a formação de uma camada
superficial de moléculas colocadas em fila
única até cobrir toda a superfície do
recipiente.
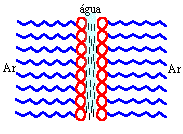 Se
a mistura for agitada ou se borbulharmos gás
(ar) nesta mistura, bolhas serão formadas na
superfície a partir da organização molecular
na forma de filmes finos, mostrado na figura
ao lado. Se
a mistura for agitada ou se borbulharmos gás
(ar) nesta mistura, bolhas serão formadas na
superfície a partir da organização molecular
na forma de filmes finos, mostrado na figura
ao lado. |
 A
bolha é um filme fino de líquido circundado por gás
(ar) por todos os lados. Este filme fino, ou no
caso de bolhas de sabão, este filme de sabão tem
propriedades elásticas, ele pode ser esticado ou
comprimido. O filme de sabão é composto por
moléculas de sabão e água. A
bolha é um filme fino de líquido circundado por gás
(ar) por todos os lados. Este filme fino, ou no
caso de bolhas de sabão, este filme de sabão tem
propriedades elásticas, ele pode ser esticado ou
comprimido. O filme de sabão é composto por
moléculas de sabão e água.
Da mesma forma que os filmes são formados também são
formadas as bolhas.
 Neste
caso teremos duas camadas
de moléculas formando o filme esférico com uma
camada de água no seu interior. As partes
apolares das moléculas estarão direcionadas para o
ar e a parte polar das moléculas direcionadas para a
água, formando um filme líquido, cuja espessura
depende do volume de água preza no meio das duas
camadas e do tamanho da molécula do surfactante. Neste
caso teremos duas camadas
de moléculas formando o filme esférico com uma
camada de água no seu interior. As partes
apolares das moléculas estarão direcionadas para o
ar e a parte polar das moléculas direcionadas para a
água, formando um filme líquido, cuja espessura
depende do volume de água preza no meio das duas
camadas e do tamanho da molécula do surfactante.

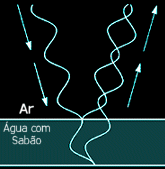 Quando
a bolha é formada uma certa quantidade de água fica
preza no interior do filme dando estabilidade ao
mesmo. Se observarmos uma bolha num dia ensolarado
ou mediante uma luz adequada veremos que haverá
mudanças de cor em sua superfície, similar as
cores do arco-íris. Esta variação de cores
ocorre devido a reflexão da
luz em sua superfície, conforme a
espessura do filme mais ou menos cores serão
refletidas ao mesmo tempo passando da cor branca,
onde todas as cores são refletidas, até a pequenos
pontos escuros onde não há reflexão alguma. Estes
pontos escuros são locais onde a espessura do filme
é menor do que um comprimento de onda da luz visível
portanto não há reflexão e portanto temos a ausência
da cor. Usando este princípio é possível portanto
medir a espessura do filme formado, conhecendo o
comprimento de onda da luz incidente. Quando
a bolha é formada uma certa quantidade de água fica
preza no interior do filme dando estabilidade ao
mesmo. Se observarmos uma bolha num dia ensolarado
ou mediante uma luz adequada veremos que haverá
mudanças de cor em sua superfície, similar as
cores do arco-íris. Esta variação de cores
ocorre devido a reflexão da
luz em sua superfície, conforme a
espessura do filme mais ou menos cores serão
refletidas ao mesmo tempo passando da cor branca,
onde todas as cores são refletidas, até a pequenos
pontos escuros onde não há reflexão alguma. Estes
pontos escuros são locais onde a espessura do filme
é menor do que um comprimento de onda da luz visível
portanto não há reflexão e portanto temos a ausência
da cor. Usando este princípio é possível portanto
medir a espessura do filme formado, conhecendo o
comprimento de onda da luz incidente.
 A
espuma é formada por um conjunto de
bolhas, umas próximas das outras, formando
um imenso tapete superficial. Pelo fato de
estarem grudadas umas as outras a sua forma
física não é esférica e sim de um
poliedro de faces
planas. A junção entre as bolhas
forma um capilar por onde o líquido pode
escorrer até formar um sistema estável ou
colapsar. A
espuma é formada por um conjunto de
bolhas, umas próximas das outras, formando
um imenso tapete superficial. Pelo fato de
estarem grudadas umas as outras a sua forma
física não é esférica e sim de um
poliedro de faces
planas. A junção entre as bolhas
forma um capilar por onde o líquido pode
escorrer até formar um sistema estável ou
colapsar. |
 |
|
Como fazer ?
|
Como vimos até aqui, podemos estudar a
tensão superficial simplesmente observando
as bolhas de sabão.
Que tal você mesmo fazer algumas bolhas?
Você vai precisar de glicerina. Faça uma
mistura 1:1 (em volume) de glicerina e água.
Adicione 5% de uma solução de surfactante
(como o detergende de cozinha). Esta será a
sua mistura para bolhas. Agora, com arames,
construa várias figuras geométricas, em duas
e três dimensões (como, por exemplo, a
estrutura tetraédrica do carbono sp3).
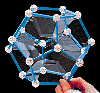 Depois,
mergulhe estes arames na solução. Observe
como que os filmes formados sempre são a
configurações que requerem a menor
surperfície. Para obter bolhas, sopre estes
filmes. Depois,
mergulhe estes arames na solução. Observe
como que os filmes formados sempre são a
configurações que requerem a menor
surperfície. Para obter bolhas, sopre estes
filmes. |
Sobre um copo de cerveja,
 a
espuma tem a função de isolante, ou seja
manter o líquido gelado e de evitar a sua
oxidação por contato do líquido com o oxigênio
do ar; desta forma a cerveja não perde sua qualidade
ao ser consumida. a
espuma tem a função de isolante, ou seja
manter o líquido gelado e de evitar a sua
oxidação por contato do líquido com o oxigênio
do ar; desta forma a cerveja não perde sua qualidade
ao ser consumida.
A espuma também é muito utilizada em extintores
de incêndio. Neste caso as bolhas deverão ser
formadas por dióxido de carbono (CO2), que evita a
propagação do fogo por falta de oxigênio.
 Através
de um suporte adequado é possível criar grandes
filmes de sabão ou detergentes ou fazer grandes
bolhas. Desta forma é possível demonstrar várias
propriedades destes filmes como mudanças de cor,
tensão superficial, estabilidade, etc. através das
mudanças de cor pode-se medir a espessura do filme e
prever quando o filme vai colapsar. Através
de um suporte adequado é possível criar grandes
filmes de sabão ou detergentes ou fazer grandes
bolhas. Desta forma é possível demonstrar várias
propriedades destes filmes como mudanças de cor,
tensão superficial, estabilidade, etc. através das
mudanças de cor pode-se medir a espessura do filme e
prever quando o filme vai colapsar. |
|
|
Home | Grafeno | Hidratos de Carbono | LHC | Bactéria GFAJ | Sperbactérias KCP | Como as cinzas prejudicam os aviões | Ônibus a Hidrogênio | Superátomos | O que os Faraós Bebiam | Metal Orgânico | Microondas no Laboratório de Química | Pré-Sal | Elementos Pseudo-metálicos | Crise Nuclear na Coreia | Crédito de Carbono | Reforma Ortográfica | Gripe Suína | Água Seca | Balança mais sensível do mundo | Chuva Seca | Adoçantes Artificiais | Estato Gasoso | Por que a água sanitária desinfeta | Adrenalina | Água | Antibióticos | Ácido Desoxirribonucleico | Armas Químicas | Armas Biológicas | Armas Nucleares | Bafômetro | Bicabonato de Sódio | Biodiesel | Bronzeamento Artificial | Bioquímica das Células | Botulismo | Cálculos em Química por Análise Dimensional | Células Tronco | Clonagem | Colesterol | Combustíveis | Ciclos Biogeoquímicos | Cristais Líquidos | Curiosidades_químicas.htm | Desodorantes | Etanol | Fenilcetonúria | Química do Vagalume | Neuroquímica | Vida | Ecstasy | Moléculas que matam | Coca Cola Diet x Bala Mentos | Química do Beijo | Novo Tipo Ligação Química | Datação do C 14 | Bioquímica da Arteriosclerose | Equilíbrio Ácido Base no Sangue | Sabão Molécula Intrigante | Cafeína | Vírus | Feromônios | Benzeno | Corantes | Nicotina | Polônio | Leptina | Raio X | Polímeros: A era dos plásticos | Vacinas Comestíveis | Química Combinatória | Gás Hélio | Sangue Artificial | Química do Cabelo | Elementos Químicos | Química Medicinal | Explosivo C4 | THC | Notícias Quânticas | Forças Intemoleculares | Gás Carbônico | Biotecnologia | Química das Aranhas | Vitaminas | Moléculas Quirais | Carboidratos | Colesterol II | Lipídios | Proteínas | Química do Sorvete | Química do Vinho | Química na Cozinha | Quimioterapia | Dicionário de Química | Diet ou Light? | Fique Por Dentro | Química das Aranhas | Gráficos | Grandes Nomes da Ciência | Histórico da Química | Lâmpadas Fluorescentes | Meio Ambiente | Mol | Os Segredos da Mumificação | Perguntas Superinteressantes | Química do Cigarro | Química do Cotidiano | Tratamento da Água | Salmonella | Pilhas e Baterias | Polímeros Condutores de Eletricidade | Umidade Relativa do Ar | Viagra | Vitaminas e Minerais
Este site foi atualizado em
04/03/19
|