 QUÍMICA DO COTIDIANO
QUÍMICA DO COTIDIANO
ÍNDICE

Cupido usando o arco e a flecha impregnados de noradrenalina
Você já ouviu esta frase: Rolou uma química
entre nós! Será que existe mesmo uma explicação científica para o
amor?
O sentimento não afeta só o nosso ego de forma figurada, mas está presente
de forma mais concreta, produz reações visíveis em nosso corpo inteiro. Se
não fosse assim como explicar as mãos suando, coração acelerado, respiração
pesada, olhar perdido (tipo "peixe morto"), o ficar rubro quando se está
perto do ser amado?
Afinal, o amor tem algo a ver com a Química? Na verdade O AMOR É QUÍMICA!
Todos os sintomas relatados acima têm uma explicação científica: são
causados por um fluxo de substâncias químicas fabricadas no corpo da pessoa
apaixonada. Entre essas substâncias estão: adrenalina,
noradrenalina, feniletilamina, dopamina, ocitocina,
a serotonina e as endorfinas. Viu como são necessários vários
hormônios para sentir aquela sensação maravilhosa quando se está amando?
A dopamina produz a sensação de felicidade, a adrenalina causa
a aceleração do coração e a excitação. A noradrenalina é o hormônio
responsável pelo desejo sexual entre um casal, nesse estágio é que se diz
que existe uma verdadeira química, pois os corpos se misturam como elementos
em uma reação química.
Mas acontece que essa sensação pode não durar muito tempo, neste ponto os
casais têm a impressão que o amor esfriou. Com o passar do tempo o organismo
vai se acostumando e adquirindo resistência, passa a necessitar de doses
cada vez maiores de substâncias químicas para provocar as mesmas sensações
do início. É aí que entra os hormônios Ocitocina e Vasopressina,
são eles os responsáveis pela atração que evolui para uma relação calma,
duradoura e segura, afinal, o amor é eterno!

O air bag é um dispositivo destinado a proteger motoristas
e passageiros em caso de colisão. Para haver um perfeito funcionamento, o
sistema envolve os seguintes mecanismos:
- sensores localizados na parte frontal do veículo;
- um dispositivo onde há substâncias químicas que reagem entre si quando
recebem um impulso elétrico;
- uma bolsa plástica que fica acondicionada dentro do ponto central do
volante de direção. No caso do passageiro, a bolsa está localizada no painel
logo acima do porta-luvas.
Mas como a bolsa plástica se enche subitamente no caso de uma colisão? E de
onde vêm os 70 litros de ar que faz inflar o saco antes da colisão? Na
verdade, este ar provém de uma reação química de decomposição. Veja como
funciona:
O air bag é formado por um dispositivo que contém a mistura química de NaN3 (azida
de sódio), KNO3 e SiO2 que é responsável pela
liberação do gás. Esse dispositivo está acoplado a um balão que fica no
painel do automóvel e quando ocorre uma colisão (ou desaceleração), os
sensores localizados no pára-choque do automóvel transmitem um impulso
elétrico (faísca) que causa a detonação da reação. Alguns centésimos de
segundo depois, o air bag está completamente inflado, salvando vidas, veja
as equações do processo:
1. NaN3 → 2 Na + 3N2
2. 10 Na + 2 KNO3 → K2O + 5 Na2O
+ N2
3. K2O + Na2O + SiO2 →
silicato alcalino
A reação produz gás nitrogênio e silicato alcalino.
Os airbags complementam a função dos cintos de segurança, agindo conjunta e
simultaneamente com o objetivo de reter o movimento dos ocupantes para
frente em fortes colisões, eles fornecem uma proteção adicional reduzindo os
riscos de ferimentos na cabeça e no tórax.

Alho é muito bom! Na verdade esta afirmação é de todos
aqueles que sabem dos benefícios deste tempero caseiro.
Mas não se preocupe, a partir deste momento você também
vai achar o alho incrivelmente apetitoso.
O dissulfeto de dipropenila é um composto capaz
de prevenir doenças cardíacas, radicais livres e atenção
mulheres: ele previne o câncer de colo de útero. E
adivinhe qual é a maior fonte deste composto? Isto
mesmo, o alho nosso de cada dia!
Mas infelizmente o alho não possui um sabor muito
agradável, principalmente na sua forma mais saudável:
cru, se fosse assim seria fácil manter altos níveis de
dissulfeto de dipropenila em nosso organismo. E o pior é
que este tempero deixa um cheiro nada agradável na boca,
você sabe por quê? O alho é composto por dois átomos de
enxofre, e são justamente estes átomos que dão um
“hálito pesado” a quem o ingere.
A boa notícia é que quando cozinhamos o alho ele perde
um pouco de cheiro característico, isto por que no
processo o dissulfeto - responsável pelo odor de alho -
é volatilizado. Desta forma fica bem mais fácil degustar
o tempero e dar um “empurrãozinho” a saúde. Mas se
realmente você não gosta de alho, nem cozido e muito
menos cru, temos uma opção: cápsulas que contém óleo de
alho. Esta alternativa surgiu para ninguém ter as
desculpas mencionadas, são cápsulas naturais que podem
ser facilmente ingeridas.
E os benefícios do alho não param por aí, ele é
considerado benéfico para cardíacos porque ajuda a
diminuir os níveis de colesterol, e previne também o
câncer gástrico, e ATENÇÃO! A dose ideal recomendada é
um dente de alho ao dia. Bom apetite!

Comecemos por definir o que é Bicarbonato de sódio: o
principal componente dos antiácidos. Conhecido
quimicamente como NaHCO3, o bicarbonato de
sódio é um pó branco que constitui uma mistura
cristalina solúvel em água. Este composto se classifica
como alcalino solúvel e recebe também a denominação de
hidrogeno carbonato de sódio.
O Bicarbonato de sódio, quando diluído, libera gás
carbônico segundo a equação:
NaHCO3 + HCl → NaCl + H2O
+ CO2
Como se vê, os produtos da reação são dióxido de
carbono, cloreto de sódio e água.
Repare que na presença de água, o NaHCO3
reage com os ácidos liberando CO2 (g), o
responsável pela efervescência. Podemos notar a presença
do dióxido de carbono ao ingerirmos o antiácido através
da liberação de gás pela boca (arroto).
Os Antiácidos estomacais tem o poder de neutralizar o
excesso de HCl (ácido clorídrico) do suco gástrico
presente em nosso estômago, mas como? O NaHCO3
é uma base e o HCl um ácido, ou seja, a base equilibra o
sistema. Este ácido auxilia na digestão dos alimentos
que ingerimos.
O desconforto estomacal pode ser ocasionado por
alimentação incorreta que estimula o estômago a produzir
mais ácido clorídrico para auxiliar na digestão, ou
ainda por ansiedade e nervosismo. Estas duas situações
ocasionam o desequilíbrio de acidez estomacal.
Até agora só apresentamos os benefícios dos antiácidos,
mas como tudo em excesso é prejudicial apresentamos o
lado negativo: se for feita a neutralização do ácido
gástrico diariamente, haverá um aumento de gases no
estômago em razão da liberação de CO2 dos
efervescentes.

Um balão
dirigível é uma aeronave mais leve do que o ar, que pode
ser controlada por um condutor. Os dirigíveis
sustentam-se através do uso de uma grande cavidade que é
preenchida com um gás menos denso do que o ar, como o
gás hélio ou mesmo o inflamável gás hidrogênio.
Conheça o
histórico dos enormes balões dirigíveis:
• No ano de 1662, Boyle enunciou a Lei dos gases,
que permitiu os vôos de balões algum tempo depois;
• Em 1782, o primeiro balão destinado ao vôo foi montado
pelos irmãos Montgolfier, era um artefato
constituído por um grande invólucro de seda, o qual
possuía uma abertura em sua parte inferior. Esta
abertura era chamada de boca, e através dela enchiam o
balão com ar quente que é menos denso, desta forma o
balão subia lentamente.
• Também no ano de 1782, Jacques Charles usou
hidrogênio em vez de ar quente para encher um balão que
projetou. O hidrogênio é 14 vezes menos denso que o ar,
e nesta mesma época um dos balões de Jacques Charles
voou a uma distância de 25 km entre Paris e uma pequena
cidade dos arredores.
• Já no ano de 1804, Joseph Gay-Lussac
conseguiu a façanha de alcançar a altitude de 7 km,
aproveitando a oportunidade ele colheu amostras naquela
altitude para fazer estudos.
• No início do século XX surgiram os grandes balões
dirigíveis – os Zeppelins- que eram usados para o
transporte de passageiros, competindo acirradamente com
os mais luxuosos transatlânticos, um destes balões fez a
volta ao mundo em outubro de 1929.
• Infelizmente em 1937, um desses balões – o
Hindenburg- com suas câmaras cheias de gás
hidrogênio explodiu provocando um incêndio de grandes
proporções e pôs fim a esse curioso meio de transporte.
Esses primeiros balões serviram para inspirar a
construção de outros balões que são usados hoje para
estudo do clima e da atmosfera.
Nos dias atuais utiliza-se o gás Hélio nos balões
meteorológicos e de publicidade, embora este gás
apresente maior densidade que o Hidrogênio, ele não
oferece nenhum perigo.
BATERIAS DE CELULAR: UMA GRANDE AMEAÇA

A modernidade trouxe um aumento nos riscos, a cada dia os aparelhos
eletrodomésticos ou eletroeletrônicos e seus componentes, inclusive pilhas,
baterias, se fazem mais presentes em nossas vidas e juntamente com esses
produtos magnetizados estão os metais pesados e não biodegradáveis:
mercúrio, chumbo, cádmio, manganês e níquel,
que fazem parte da composição de muitos aparelhos modernos.
As baterias recarregáveis representam hoje cerca de 8% do mercado europeu de
pilhas e baterias. Dentre elas pode-se destacar a de níquel-cádmio (Ni-Cd)
devido à sua grande representatividade: as baterias de celular são de
Ni-Cd.
Composição Química das baterias de níquel-cádmio:
elas têm um eletrodo (cátodo) de Cd, que se transforma em
Cd(OH)2, e outro (ânodo) de
NiO(OH), que se transforma em
Ni(OH)2. O eletrólito é uma mistura
de KOH e Li(OH)2.
As
baterias de telefones celulares não devem ir para o lixo comum, pois quando
depositadas em lixões, suas substâncias tóxicas contaminam os lençóis d’água
subterrâneos.
Através da cadeia alimentar, essas substâncias chegam, de forma acumulada,
aos seres humanos.Os metais pesados contidos nas baterias, quando
absorvidos, são de difícil eliminação pelo organismo, podendo causar
diversos efeitos nocivos ao ser humano, tais como: alergias de pele e
respiratórias; náuseas e vômitos; diarréias; diminuição do apetite e do
peso; dores de estômago e gosto metálico na boca; instabilidade, com
distúrbio do sono; inibição das células de defesa do organismo e bronquite.
Pode inclusive causar danos ao sistema nervoso, edemas pulmonares,
osteoporose e alguns tipos de câncer.
O volume global de baterias recarregáveis vem crescendo 15% ao ano.
Em geral, os brasileiros trocam de celular a cada 18 meses, embalados pelas
novidades de dispositivos sofisticados e pelo incentivo das operadoras, que
chegam até a oferecer aparelhos gratuitamente.
O perigo está quando as baterias se estragam e não podem mais ser
recarregadas ou reutilizadas, e são então descartadas, não tendo mais função
para o consumidor comum. As empresas de telefonia recomendam que o descarte
seja feito nas próprias lojas de celulares, que funcionam como pontos de
coleta de baterias, esse material é destinado às empresas que promovem a
reutilização ou reciclagem.

Ela é
uma droga poderosa e socialmente aceita, além de ser saborosa; será que a
Cafeína é mesmo inofensiva? Possui a propriedade de manter uma pessoa ligada
por mais de três horas, sem grandes riscos e sem efeito colateral: mito ou
verdade?
A cafeína é um composto químico, conhecido cientificamente por
trimetilxantina de fórmula C8H10N4O2,
é o principal componente do nosso famoso café. Segundo estudos, essa bebida
estimula o sistema nervoso e causa efeitos como: aumento da concentração,
atenção e memória.
Os efeitos da cafeína no organismo variam de pessoa para pessoa. Alguns
fatores influem no resultado como a idade, o peso e a capacidade do fígado
de digerir esta substância. Em média, uma xícara de café já é suficiente
para deixar um adulto alerta de 3 a 6 horas.
A explicação fisiológica para este contexto provém do neurotransmissor
Adenosina, esta substância produzida no cérebro é a responsável pela
sensação de sono, é ela que prepara nosso corpo para o descanso ao final do
dia. O que a cafeína faz é impedir a ação da Adenosina e em conseqüência
disso aparecem os sintomas de alerta e perda de sono. Resumindo: no cérebro
a cafeína é confundida com a Adenosina. A cafeína então ocupa o lugar da
Adenosina e reverte todo o processo.
Já que a reação corre no cérebro, a cafeína pode então causar dependência?
Ela age como uma droga, apesar de ser leve, mas estudos já comprovaram que
pessoas que ingerem café regularmente ficam ansiosos, irritados ou com dor
de cabeça se não tomarem sua dose diária. Mas é bom não exagerar na bebida,
uma quantidade superior a 500 miligramas de cafeína (o equivalente a 3
xícaras de café expresso forte) podem levar a um processo de intoxicação.
CÉBOLA E LÁGRIMAS: A QUÍMICA EXPLICA

Qual a relação entre a química e as lágrimas que surgem quando cortamos
cebolas? A química está envolvida desde o cheiro até a reação que provoca em
nossos globos oculares, a cebola possui várias substâncias químicas que
estimulam nosso olfato, paladar e infelizmente nossos olhos.
Vamos começar pelo cheiro, qual composto é responsável por aquele delicioso
cheirinho de cebola frita na manteiga? São os óxidos de enxofre (SO2
e SO3) provenientes do ácido sulfúrico (H2SO4).
Agora para explicar sobre as lágrimas precisamos ir um pouco além. Quando
realizamos o corte de uma cebola, esta libera enzimas denominadas de
alinases, estas por sua vez reagem com o óxido sulfúrico (SO3) já
presente na estrutura da cebola. A reação dá origem ao ácido sulfúrico que,
por ser pouco estável, acaba se transformando em um gás volátil.
SO3(g) + H2O → H2SO4(aq)
Cebola lágrima
lacrimação
O gás obtido na reação ao se volatilizar chega até os olhos provocando uma
reação desagradável nos terminais nervosos da córnea, e para se defender
estes terminais ativam as glândulas lacrimais, estas por sua vez liberam as
lágrimas: a hora do choro!
Existem diversas maneiras de prevenir este aborrecimento, um deles é cortar
as cebolas utilizando o ventilador. Ligue um ventilador ao seu lado e em
direção transversal apontado para a cebola de modo que o gás não chegue aos
seus olhos, faça o teste e constate o que foi exposto aqui.
CLASSIFICAÇÃO DOS EXTINTORES DE INCÊNDIO

Incêndios podem ser definidos como a presença de fogo em local não
desejado. São capazes de provocar, além de prejuízos materiais, quedas,
queimaduras e intoxicações por fumaça.
O fogo, por sua vez, é resultante de uma reação química em cadeia, e para
que esta reação ocorra são necessários:
• Material oxidável (combustível);
• Material oxidante (comburente);
• Fonte de ignição (energia) e
• Reação em cadeia.
- Combustível é o material oxidável (sólido, líquido ou gasoso) capaz de
reagir com o comburente numa reação de combustão;
- Comburente é o material gasoso (em geral o oxigênio) que pode reagir com
um combustível, produzindo assim a combustão;
- Ignição é o agente que dá o início do processo de combustão, é a energia
mínima inicial necessária introduzida na mistura combustível/comburente;
- Reação em cadeia é o processo de sustentabilidade da combustão, pela
presença de radicais livres que são formados durante o processo de queima do
combustível.
É de extrema importância conhecer e identificar bem o incêndio que se vai
combater, antes de escolher o agente extintor (equipamento de combate ao
fogo). Um erro na escolha de um extintor pode tornar inútil o esforço de
combater as chamas, podendo até piorar a situação: aumentar ou espalhar
ainda mais as chamas, ou criar novas causas de fogo (curtos-circuitos).
Os principais tipos de extintores são os seguintes:
1. Extintor H2O: água na forma líquida (jato ou
neblina);
2. Extintor à base de Espuma: espuma mecânica;
3. Extintor de Gases e vapores inertes: gás carbônico (CO2),
Nitrogênio, Vapor d´água;
4. Extintor Pó químico: bicarbonato de sódio (NaHCO3).
Classes de incêndio:
A - Materiais sólidos fibrosos, tais como: madeira, papel,
tecido, etc. que se caracterizam por deixar, após a queima, resíduos como
carvão e cinza. Essa classe de incêndios deve ser combatida com extintores
de H2O ou de Espuma;
B - Líquidos e gases inflamáveis, ou em sólidos que se
liquefazem para entrar em combustão: gasolina, GLP, parafina, etc. Neste
caso NÃO se pode usar extintores à base de água;
C - Equipamentos elétricos energizados: motores, geradores,
cabos, etc. Extintores de pó químico e de Gases são os permitidos para esse
tipo de incêndio
 A
Química, com seu vasto campo de atuação, possibilita
descobertas importantes para a melhoria da qualidade de
vida. Na indústria, por exemplo, essa ciência
possibilita a criação de novos sólidos através da
combinação de dois ou mais materiais já existentes,
melhorando assim as propriedades de inúmeros objetos.
A
Química, com seu vasto campo de atuação, possibilita
descobertas importantes para a melhoria da qualidade de
vida. Na indústria, por exemplo, essa ciência
possibilita a criação de novos sólidos através da
combinação de dois ou mais materiais já existentes,
melhorando assim as propriedades de inúmeros objetos.
Os composites ou compósito foram elaborados a partir deste princípio, e já existem há milhares de anos, alguns surgiram acompanhando a evolução histórica. No século X a.C., os Assírios e os Babilônios produziam tijolos de argila com palha no seu interior. Essa técnica deu origem a um composite, que é mais duro e mais resistente à ação do tempo, ao contrário do tijolo comum que é mais quebradiço.
Podemos citar como composites modernos: tacos de golfe, raquetes de tênis, skates.
Esses objetos são feitos de composite formado por fibra de carbono e resina. A função da resina é manter as fibras unidas, além de dar resistência à resina, impedem a deformação e amortecem as vibrações. Esse material fica tão resistente que é usado em asas e fuselagem de aviões.
Um exemplo de um composite natural está em nosso próprio corpo: os ossos. Eles são constituídos por fibras elásticas de colágeno revestidas de uma estrutura sólida de fosfato de cálcio. Em idosos os composites se tornam quebradiços, devido à diminuição da quantidade de colágeno.
A cerâmica usada na fabricação de xícaras e pratos, quando enriquecida com fibras de grafite se torna bem menos quebradiça, resistente a altas temperaturas e mais leve. Esse composite é usado para revestir ônibus espaciais e foguetes, devido a essas propriedades.
 Dioxina
é um nome genérico dado a toda uma família de subprodutos indesejáveis da
síntese de herbicidas, desinfetantes e outros. A dioxina mais comum é a
tetraclorodibenzeno-p-dioxina, (2, 3, 7, 8 - TCDD), ela faz parte de um
grupo de compostos persistentes no meio ambiente e altamente tóxicos. Essa
substância é cancerígena, e provém da poluição gerada por indústrias, como
por exemplo, é um subproduto da produção de inseticidas clorados.
Dioxina
é um nome genérico dado a toda uma família de subprodutos indesejáveis da
síntese de herbicidas, desinfetantes e outros. A dioxina mais comum é a
tetraclorodibenzeno-p-dioxina, (2, 3, 7, 8 - TCDD), ela faz parte de um
grupo de compostos persistentes no meio ambiente e altamente tóxicos. Essa
substância é cancerígena, e provém da poluição gerada por indústrias, como
por exemplo, é um subproduto da produção de inseticidas clorados.
 No ano de 2004, um trágico acontecimento aconteceu com o candidato da
oposição à presidência da Ucrânia, Viktor Yushchenko, ele foi envenenado com
a dioxina do tipo TCDD, citada acima, que é a mais perigosa. Ele ficou com o
rosto deformado como conseqüência do atentado.
No ano de 2004, um trágico acontecimento aconteceu com o candidato da
oposição à presidência da Ucrânia, Viktor Yushchenko, ele foi envenenado com
a dioxina do tipo TCDD, citada acima, que é a mais perigosa. Ele ficou com o
rosto deformado como conseqüência do atentado.
Já
a contaminação pela "dioxina", em pequenas doses, não é facilmente notável
porque, em curto espaço de tempo, não gera sintomas. Mas, como são
cumulativas no organismo, as intoxicações pela "dioxina" podem provocar
doenças fatais, sem marcas e sem qualquer identificação da origem.
A dioxina é hoje considerada a mais violenta substância gerada pelo homem,
seu grau de periculosidade ultrapassa até o urânio e o plutônio. Esta
substância surge quando moléculas de cloro são submetidas a altas
temperaturas, em presença de matéria orgânica, nestas condições algum tipo
de dioxina é gerada, visto que a dioxina é membro de uma numerosa família
que atinge 200 membros, onde se incluem os furanos, igualmente periculosos.
Entre as conseqüências da inalação da dioxina, o surgimento do câncer pode
estar associado, como também o extermínio das defesas orgânicas (doença
comparada à AIDS). Se uma mulher em gestação for exposta a estes riscos, seu
bebê pode nascer com sérios problemas (ausência de cérebro e nariz).
É preciso tomar muito cuidado com a queima de produtos que contém cloro. Por
exemplo, o PVC é inofensivo em si, mas a sua queima gera dioxina, além do
que, para esse produto, haverá a liberação de ácido cianídrico que é um
poderoso tóxico.

Os macroelementos são aqueles cuja necessidade diária é superior a
100 mg, ocorrem em quantidades relativamente altas em um ou mais tecidos e
são requeridos nas dietas em concentrações de 0,05 a 0,5%. Os principais
macroelementos são:
• Fósforo;
• Potássio;
• Sódio;
• Enxofre;
• Cálcio;
• Cloro.
Os microelementos, chamados de elementos-traço, também precisam ser ingeridos, pois são importantes, apesar da necessidade diária ser inferior a 100 mg. Dentre eles encontramos:
• Ferro;
• Flúor;
• Iodo;
• Cobre;
• Zinco;
• Manganês, dentre outros.
 Fotossíntese
é a síntese de carboidrato a partir de água e dióxido de carbono (CO2).
O que caracteriza uma reação de fotossíntese é a absorção de luz e, é
através dela que ocorre a produção de alimentos nos vegetais, sendo assim,
ela é indispensável para a vida das plantas, dos animais e até do homem. As
folhas das plantas possuem células fotossintetizadoras, que são sensíveis à
luz e possuem uma substância denominada clorofila.
Fotossíntese
é a síntese de carboidrato a partir de água e dióxido de carbono (CO2).
O que caracteriza uma reação de fotossíntese é a absorção de luz e, é
através dela que ocorre a produção de alimentos nos vegetais, sendo assim,
ela é indispensável para a vida das plantas, dos animais e até do homem. As
folhas das plantas possuem células fotossintetizadoras, que são sensíveis à
luz e possuem uma substância denominada clorofila.
A clorofila é o pigmento mais importante no processo fotossintético das
plantas, ela capta a radiação luminosa e transforma essa forma de energia em
energia química. A energia luminosa utilizada para essa reação é provinda da
luz solar e absorvida pela clorofila. A absorção da energia luminosa e sua
transformação em energia permitem o crescimento das plantas, seu
florescimento e a produção de frutos.
Assim como a energia solar é fundamental para a fotossíntese, esta é
importante para o homem porque ao ingerir o alimento proveniente das
plantas, parte das substâncias entra na constituição celular e outra parte
fornece a energia necessária às atividades como o crescimento, a reprodução,
etc.
A Fotoquímica é o processo químico da fotossíntese, ela utiliza a luz do Sol
para as reações, por este motivo é que é chamada de “Reação de claro”.
Na fotoquímica acontecem dois processos básicos: a fotólise da água e a
fotofosforilação.
Fotólise da Água:
Neste processo ocorre a transferência dos átomos de hidrogênio para os
transportadores de hidrogênio e a liberação do oxigênio para a atmosfera. A
descrição dessa reação foi feita por Hill, em 1937. No entanto, esse
pesquisador não sabia qual era a substância receptora de hidrogênio,
atualmente sabe-se que tal substância é o NADP (nicotinamida-adenina-dinucleotídeo+ácido
fosfórico).
Fotofosforilação:
Adição de fosfato em presença da luz. A substância que sofre
fotofosforilação na fotossíntese é o ADP, formando
ATP. É neste processo que as plantas produzem e armazenam energia
para a etapa química da fotossíntese.
Sendo assim, a fase fotoquímica da fotossíntese tem como função converter a
energia luminosa em energia química. Mas como isso é feito?
Quando a luz incide em uma molécula de clorofila, essa absorve parte da
energia luminosa que permite a reação do gás carbônico com água, produzindo
carboidratos e liberando oxigênio. Observe a equação:
6 CO2(g) + 6 H20(l)
+ calor => C6H12O6(aq) + 6 O2(g)
O catalisador dessa reação é a clorofila, ou seja, ela não se
desgasta e nem é consumida, apenas ativa a reação. A reação química que
ocorre na fotossíntese pode ser esquematizada da seguinte forma:
gás carbônico + água +
luz = glicose + oxigênio
FRITZ HABER: SÍNTESE DA AMÔNIA
 Você
sabia que a amônia está entre as cinco substâncias mais produzidas no mundo?
E a descoberta de sua síntese foi digna de prêmio Nobel? Ela é tão
importante que dela depende nosso próprio sustento, a nossa alimentação não
seria a mesma se não existisse o processo de sintetização da amônia.
Você
sabia que a amônia está entre as cinco substâncias mais produzidas no mundo?
E a descoberta de sua síntese foi digna de prêmio Nobel? Ela é tão
importante que dela depende nosso próprio sustento, a nossa alimentação não
seria a mesma se não existisse o processo de sintetização da amônia.
Sir Willian Ramsey (1852-1916) em 1898 fez uma previsão que
aterrorizou a humanidade: a produção de alimentos cairia desastrosamente em
razão da falta de fertilizantes nitrogenados, tudo porque até então só
existiam na forma natural e já se encontravam escassos.
Mas foi aí que o trabalho de um cientista fez toda a diferença, o químico
Fritz Haber (1868 – 1934) com a ajuda do engenheiro William Carl
Bosch (1874 – 1940), criou um processo de síntese da amônia, ou seja, ela
poderia ser produzida de forma artificial. Veja a equação que representa o
processo:
N2(g) + 3 H2(g) ↔ 2 NH3(g)
∆ H = -92,22 Kj
A amônia pode ser usada diretamente como fertilizante ou ainda constituir
matéria prima principal para a produção de fertilizantes nitrogenados. Outra
utilização da amônia é para a produção de explosivos, esta aplicação também
foi descoberta por Haber. O cientista notou que quando a amônia é oxidada
produz ácido nítrico, componente essencial para a obtenção de pólvora.
Estas descobertas renderam a Fritz Haber um prêmio Nobel de Química
no ano de 1918. Haber teve uma contribuição valiosa para a Alemanha durante
a Primeira Guerra Mundial, através de seus estudos sobre a aplicação da
amônia para produzir a pólvora foi possível reduzir os custos na obtenção de
explosivos usados em grande escala nas batalhas.
Por ironia do destino, apesar das contribuições prestadas à Alemanha durante
a Guerra, Fritz Haber foi perseguido pelos nazistas por ser judeu,
e teve que se ausentar do país.
 Quem
já descuidadamente teve contato com o sumo ou caldo de pimenta nos olhos
sabe o quanto é insuportável a dor e a queimação que ele causa. Isso porque
há uma série de substâncias irritantes e inflamatórias que plantas desse
grupo possuem.
Quem
já descuidadamente teve contato com o sumo ou caldo de pimenta nos olhos
sabe o quanto é insuportável a dor e a queimação que ele causa. Isso porque
há uma série de substâncias irritantes e inflamatórias que plantas desse
grupo possuem.
Um dos grupos de pimentas e também dos pimentões que utilizamos normalmente
na culinária, o gênero Capsicum, possui em sua constituição química
uma substância chamada capsicina (8-metil-vanilil-6-nonenamida),
a qual em contato com as mucosas (vias respiratórias, pele e olhos)
produz uma severa reação inflamatória. Curiosamente essa substância
foi e ainda é utilizada como indutora de tosse, quando da necessidade de
avaliações e experiências de sensibilidade do reflexo de tosse, para testes
clínicos e farmacológicos.
Porém, seu uso mais controverso está relacionado com o conhecido “spray de pimenta” ou gás de pimenta. Utilizado pela polícia em vários países do mundo como arma-não-letal para controle de multidões e principalmente para conter agressores, o spray de pimenta também é empregado como arma de autodefesa para civis.
O spray de pimenta contém basicamente, em sua formulação, porcentagens variadas de óleo-resina de Capsicum, que possui como princípio ativo a capsicina, e um solvente (um álcool como etanol ou isopropanol), ou ainda substâncias como silicone, quando o spray tem o objetivo de impregnar o ambiente.
Em contato com os
olhos, assim como na pele e vias respiratórias, a capsicina causa um efeito
inflamatório que gera uma sensação de dor e ardor levando a cegueira
temporária e conseqüente imobilização, o processo se dá devido à
liberação de neuropeptídios das terminações nervosas. O seu efeito depende
tanto da porcentagem de óleo-resina existente no spray quanto do tempo de
exposição, mas em média, é em torno de 15 a 60 minutos. As
controvérsias maiores resultam do pouco conhecimento sobre o efeito
desta substância a longo prazo, embora estudos apontem que não
causem lesões permanentes se houver um único contato. Outro fator é a
sensibilidade e doenças respiratórias preexistentes, uma vez que o contato
com essa substância pode causar dificuldade respiratória e, algumas vezes
foram aludidas como causadoras de morte.
 Muitos
protestos violentos são dispersos pelos policiais com a ajuda do Gás
Lacrimogênio. Este gás orgânico começou a ser utilizado na Primeira Guerra
Mundial, ele pertence à classe dos Haletos que são compostos que apresentam
pelo menos um átomo do grupo dos Halogênios (F, Cl, Br, I), ligado a um
grupo derivado de hidrocarboneto.
Muitos
protestos violentos são dispersos pelos policiais com a ajuda do Gás
Lacrimogênio. Este gás orgânico começou a ser utilizado na Primeira Guerra
Mundial, ele pertence à classe dos Haletos que são compostos que apresentam
pelo menos um átomo do grupo dos Halogênios (F, Cl, Br, I), ligado a um
grupo derivado de hidrocarboneto.
Nas manifestações de rua os policiais não podem acalmar a euforia da
multidão com armas de fogo, sendo assim, o uso do gás é uma opção válida já
que este apresenta baixa toxicidade, e faz com que as vítimas soltem
lágrimas incessantes e se afastem. A palavra "Lacrimogêneo" vem do Latim "lacrima"
que significa lágrima.
É também reconhecido pela sigla CS, cuja composição é gás (o-Clorobenzilideno
malononitrilo). É um agente incapacitante, ou seja, os efeitos resultantes
do contato com tais substâncias atrapalham qualquer indivíduo de realizar
tarefas, já que vai estar muito ocupado tentando respirar ou esfregando os
olhos (inutilmente). Além de lágrimas, o gás ainda pode causar: tosse,
irritação da pele e vômitos. A queda do líquido irritante na pele causa
sensação de queimadura. Os efeitos levam entre 20 a 45 minutos para passar.
Esses gases podem ser dispersos por meio de sprays (aerosol) ou na forma de
granadas de mão como projéteis a serem lançados.
GELO: PROTEÇÃO CONTRA O FRIO NOS PÓLOS
 Quais
transformações a água sofre ao passar para o estado sólido? Sabemos que a
água possui propriedades únicas em relação a outros líquidos, neste contexto
o estado sólido vai merecer uma atenção especial e a propriedade que permite
explicar as características deste estado físico da matéria é a densidade.
Quais
transformações a água sofre ao passar para o estado sólido? Sabemos que a
água possui propriedades únicas em relação a outros líquidos, neste contexto
o estado sólido vai merecer uma atenção especial e a propriedade que permite
explicar as características deste estado físico da matéria é a densidade.
A água na fase sólida é menos densa que na fase líquida, ou seja, o gelo é
menos denso, sendo assim ele flutua na superfície. Graças a essa
particularidade da água é possível a vida submarina nos pólos, que são
regiões gélidas. Além disso, o gelo não é um bom condutor de temperaturas,
funciona como um isolante térmico, os animais que se encontram abaixo desta
espessa camada de gelo ficam protegidos contra o frio mais intenso. A
temperatura externa nas regiões de muito frio se encontra bem abaixo da
temperatura da água.
Mas o que exatamente ocorre com as moléculas de água quando passam para o
estado sólido? A água que se encontra no estado líquido possui as ligações
de hidrogênio unindo os átomos, estas ligações são constantemente quebradas
e refeitas, este processo permite o estado líquido. Agora no estado sólido,
estas ligações não são mais quebradas e permanecem unidas em forma de uma
rede cristalina, este novo formato da água permite que o gelo flutue.
Afinal, como seria a vida aquática se o gelo não flutuasse sobre a água? Com
certeza os animais que moram nas regiões mais frias do planeta já teriam
entrado para a lista de animais extintos. Mas infelizmente esta realidade já
existe, o aquecimento global é uma ameaça, é responsável pelo derretimento
das calotas polares.

Esse processo é conhecido por Sublimação e consiste na passagem de um sólido
ao estado de vapor sem antes passar pelo estado líquido, ou seja, à medida
que o gelo-seco é aquecido, ele se transforma diretamente em dióxido de
carbono gasoso e não em líquido.
Quando o ar quente (ou água) passa sobre o gelo-seco, forma-se uma densa
nuvem branca, que permanece ao nível do chão, produzindo o efeito especial
usado no cinema. Mas não é só para esse fim que o dióxido de carbono sólido
é usado, a temperatura extremamente gelada e a característica da sublimação
fazem do gelo-seco uma excelente opção para refrigeração. Por exemplo, se
você precisar fazer uma longa viagem com um produto congelado, você pode
revesti-lo com gelo-seco. O produto estará congelado quando chegar ao
destino e com a vantagem de que nada estará molhado, diferentemente do que
aconteceria se fosse usado gelo normal.
Mas como é produzido o dióxido de carbono congelado? Para se fazer gelo-seco
é preciso começar com um recipiente de alta pressão cheio de dióxido de
carbono líquido. Quando se libera o dióxido de carbono líquido do tanque, a
expansão do líquido e a alta velocidade de evaporação do dióxido de carbono
gasoso esfriam o restante do líquido ao ponto de congelamento, no qual ele
se transforma diretamente em sólido.
Você alguma vez já viu um extintor de incêndio de dióxido de carbono em
ação? É formada no bocal uma espécie de "neve", esse tipo de extintor contém
dióxido de carbono líquido em alta pressão.
Acompanhe o processo de evolução da anestesia, a responsável pela
revolução na medicina:
5000 a.C. ao século XI d.C:
nesta época os métodos eram bem naturais, os egípcios usavam plantas que
causavam o efeito sedativo, já os chineses utilizavam a acupuntura para
anestesiar os pacientes (este método utiliza de agulhas anexadas ao corpo
para obter um relaxamento).
Século XVI ao século XVIII: o
álcool era empregado em pacientes que iriam se submeter a pequenas
cirurgias, como as extrações dentárias. A ingestão do álcool não era muito
eficiente, e o paciente acabava sentindo alguma dor.
1773: neste ano foi descoberta
a existência do gás dióxido de nitrogênio, este gás possuía a propriedade de
deixar o paciente inconsciente, era aplicado por inalação.
1846: foi o ano em que
aconteceu a primeira cirurgia com anestesia geral, em razão da repercussão,
foi realizada em público nos Estados Unidos. Uma substância capaz de tirar
uma pessoa de seu estado normal, levando-a a desmaiar e permitir assim o
trabalho dos médicos, qual seria ela? O éter, que ao ser inalado provoca um
desvio dos sentidos, o paciente ficava desacordado.
1930-1970: chegou a vez das
anestesias injetáveis, elas eram mais seguras e neste mesmo período surgiram
as salas de recuperação pós-operatório, ou seja, houve um grande avanço no
que diz respeito às cirurgias. A primeira anestesia por via sanguínea foi o
ciclopropano.
1980-2008: nesta época a
tecnologia permitiu inserir computadores nas salas de cirurgia, eles ficaram
responsáveis pela monitoração do paciente. Este foi um importante passo na
história da Anestesia, graças aos modernos aparelhos é possível registrar as
funções vitais e administrar até mesmo os medicamentos aplicados.
Mas como as modernas anestesias fazem o paciente dormir
profundamente?
Os anestésicos caem na corrente sanguínea e vão diretamente para o cérebro,
lá estão presentes as substâncias que se ligam aos neurônios para manter o
corpo acordado, e é justamente sobre esta ação que as anestesias influem. Os
anestésicos bloqueiam a ação destas substâncias presentes no cérebro levando
a um relaxamento do corpo e a total perca da consciência.
 A
nova Lei 11.705, que altera o Código de Trânsito
Brasileiro, já provocou mudanças nos hábitos da
população brasileira. Antes, era permitida a ingestão de
até 6 decigramas de álcool por litro de sangue (o
equivalente a dois copos de cerveja), agora é preciso
ser muito cauteloso na ingestão de bebidas alcoólicas
antes de dirigir.
A
nova Lei 11.705, que altera o Código de Trânsito
Brasileiro, já provocou mudanças nos hábitos da
população brasileira. Antes, era permitida a ingestão de
até 6 decigramas de álcool por litro de sangue (o
equivalente a dois copos de cerveja), agora é preciso
ser muito cauteloso na ingestão de bebidas alcoólicas
antes de dirigir. Com esta nova legislação, o motorista que for flagrado com nível de álcool acima do permitido (0,1 mg/l de sangue) terá que pagar uma multa de R$ 955, terá o carro apreendido e ainda perde a habilitação.
A pior conseqüência é para quem estiver embriagado (níveis acima de 0,3 mg/l): o motorista corre o risco de ser preso, e a detenção é de 6 meses a 1 ano.
E por que a nova lei coloca o Brasil entre os países mais rígidos do mundo?
- A Polícia Rodoviária Federal está bem equipada, possui 1 bafômetro para cada 122 Km de rodovias.
- A dose fatal: é correspondente a 0,1 mg de álcool por litro de baforada. Para atingir esta concentração, basta uma taça de vinho ou uma tulipa de chope.
Como se vê, o bafômetro é um simples aparelhinho portátil que permite medir toda e qualquer concentração de álcool no sangue do motorista, ou seja, é mais fácil ficar só no refrigerante que enganar a tecnologia. Veja agora quanto tempo em média o álcool leva para desaparecer de seu corpo:
Um copo de cerveja (350 ml) – 1 hora;
Uma dose de vinho (150 ml) – 1 hora e 25 minutos;
Uma dose de uísque, tequila ou pinga (50 ml) – 1 hora e 15 minutos.
E não adianta reclamar dizendo que o aparelho está estragado, a margem de erro do bafômetro, segundo o Inmetro, é de apenas 1 %.
 As
reações em que ocorre perda ou ganho de elétrons são
denominadas de reações de oxirredução. Elas são muito
importantes em nosso cotidiano, estão presentes em
diversas invenções tecnológicas, e é com base nelas que
podemos explicar a química envolvida nas lentes
fotossintéticas dos óculos de sol.
As
reações em que ocorre perda ou ganho de elétrons são
denominadas de reações de oxirredução. Elas são muito
importantes em nosso cotidiano, estão presentes em
diversas invenções tecnológicas, e é com base nelas que
podemos explicar a química envolvida nas lentes
fotossintéticas dos óculos de sol. Tudo começa pela composição do vidro fotocromático: quando átomos de oxigênio tetraédricos se ligam com silício surge uma estrutura cristalina de cloreto de prata. Essa estrutura se encontra desordenada, de forma que existem brechas entre os átomos, sendo assim, a luz visível passa através desta estrutura.
As vantagens das lentes fabricadas com vidro fotocromático é que elas não deixam a luz ultravioleta passar, elas absorvem essa luz, surge então uma reação de oxirredução entre íons de prata e cloro. Veja a equação:
Ag+ + Cl- → Cu2+ + Cl-
Através dessa reação se formam os cristais de cloreto de prata, mas, para que a reação não se torne reversível, se adiciona íons Cu+. Acompanhe a reação:
Cu+ + Cl0 → Cu2+ + Cl-
Repare que os íons Cu+ reagiram com os átomos de cloro formados na reação anterior. A maior dúvida é: como a lente escurece na presença de luz? A prata metálica coloidal se forma na superfície das lentes, ela possui a propriedade de absorver a luz, o que torna a lente escura para proteger os olhos da luz ultravioleta.
Mas por que quando voltamos para o ambiente escuro as lentes clareiam novamente? Porque os íons cloreto presentes no cristal do vidro fotocromático se unem novamente a íons de prata através de rearranjos moleculares.
Agora você já sabe por que as lentes fotossensíveis são mais indicadas para a boa saúde dos olhos: o bloqueio dos raios ultravioleta.
 A
cada dia que passa está mais difícil para um criminoso esconder vestígios da
polícia, pode ser o fim dos homicídios sem solução. Mesmo que o assassino
lave cuidadosamente o local do crime ou que tenha se passado até seis anos,
é possível identificar os mínimos vestígios de sangue em praticamente
qualquer tipo de superfície, mesmo as lisas como os azulejos.
A
cada dia que passa está mais difícil para um criminoso esconder vestígios da
polícia, pode ser o fim dos homicídios sem solução. Mesmo que o assassino
lave cuidadosamente o local do crime ou que tenha se passado até seis anos,
é possível identificar os mínimos vestígios de sangue em praticamente
qualquer tipo de superfície, mesmo as lisas como os azulejos.
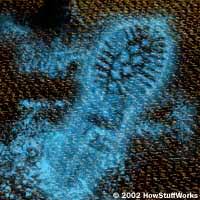
O responsável por esse avanço é o Luminol, que é um produto químico especial
capaz de fazer aparecer traços de sangue até então invisíveis a olho nu, se
tornando um grande aliado dos investigadores para revelar cenas ocultas de
um crime.
O processo começa pelo reconhecimento do local onde se passou o crime, o
Luminol então é aplicado com borrifadores especiais nas possíveis áreas onde
pode haver resquícios sanguíneos. A reação acontece quando as moléculas do
Luminol entram em contato com o sangue. As partículas de ferro existentes na
hemoglobina (uma proteína do sangue) se acendem gerando uma intensa luz azul
que pode ser vista em um local escuro ou no momento em que se apaga a luz do
ambiente.
Assim que a substância se mistura à hemoglobina, bastam apenas 5
(cinco) segundos para a luz radiante se tornar visível. A sua utilização é
muito importante, pois a partir das manchas de sangue pode-se sugerir uma
dinâmica do que teria acontecido e assim solucionar o crime.
Com a ajuda do Luminol, os pesquisadores conseguem detectar até traços de
DNA que permitem o reconhecimento da vítima e do culpado. O processo químico
responsável por essa façanha é chamado de quimiluminescência, fenômeno
similar ao que faz vaga-lumes e bastões luminosos brilharem.
Segundo os pesquisadores responsáveis pela elaboração do Luminol, é
praticamente impossível alguém limpar o sangue de uma forma que o Luminol
não consiga identificá-lo. Por exemplo, em uma pia completamente branca que
seja lavada várias vezes com fortes produtos de limpeza (água sanitária),
mesmo assim a substância encontrará indícios quando tiver sangue.
NITRATO DE CELULOSE: A INVENÇÃO DO CINEMA
 Nitrato
de celulose é um material altamente inflamável, como o próprio nome indica,
é produzido a partir da celulose (polpa da madeira) com ácido nítrico
concentrado, pertence à classe dos ésteres, mas por que será que o nitrato
de celulose recebe também a denominação de filme? A resposta tem a ver com a
primeira utilização desse tipo de plástico. Antes de falar sobre o filme,
conheça a história do nitrato de celulose: ele foi descoberto no ano de
1846, apresenta propriedades como alta inflamabilidade e solubilidade. E é
graças à capacidade de derreter que é possível moldar esse material e
transformá-lo em uma diversidade de objetos com dureza e elasticidade
elevados.
Nitrato
de celulose é um material altamente inflamável, como o próprio nome indica,
é produzido a partir da celulose (polpa da madeira) com ácido nítrico
concentrado, pertence à classe dos ésteres, mas por que será que o nitrato
de celulose recebe também a denominação de filme? A resposta tem a ver com a
primeira utilização desse tipo de plástico. Antes de falar sobre o filme,
conheça a história do nitrato de celulose: ele foi descoberto no ano de
1846, apresenta propriedades como alta inflamabilidade e solubilidade. E é
graças à capacidade de derreter que é possível moldar esse material e
transformá-lo em uma diversidade de objetos com dureza e elasticidade
elevados.
O nitrato de celulose foi o primeiro plástico a ser descoberto, mas porque
foi usado para fazer filmes? Em razão da propriedade de se esticar em longas
tiras que correspondem às películas de filmes, aqueles grandes rolos dos
filmes antigos de cinema. Nos dias atuais o nitrato de celulose não é mais
usado para essa finalidade, porque é muito inflamável e muitas relíquias de
cinema foram consumidas em incêndios provenientes desse material.
Mas não foi só no cinema que o primeiro plástico se destacou, ele foi usado
na fabricação de alguns objetos como: bolas de bilhar, teclados de piano,
cabos de instrumentos de corte, puxadores de armários, etc. Antes de serem
obtidos do nitrato de celulose, esses objetos eram retirados do marfim
(dentes de elefantes).
Pode-se dizer que o primeiro plástico deu um grande passo na preservação da
fauna, já que os elefantes estavam sendo cruelmente abatidos para a retirada
de seus dentes.
Inclusive o inventor do Nitrato de celulose, o químico alemão Christian
Frie-drich Schonbein, ganhou um prêmio pela descoberta do plástico que
substituiu o marfim e ajudou na preservação da espécie animal, o que evitou
a extinção dos elefantes.
O INFERNO É EXOTÉRMICO OU ENDOTÉRMICO
 É
claro que este assunto está na forma figurada, se o
inferno existe ou não é um assunto para ser discutido
pelos religiosos, e quem já foi espero que não volte
para contar como é este lugar tão temido pela
humanidade. No entanto, podemos fazer uma análise do
inferno nos baseando no conceito dos processos
endotérmicos e exotérmicos. Mas primeiramente uma
definição dos diferentes tipos de reação frente ao
calor:
É
claro que este assunto está na forma figurada, se o
inferno existe ou não é um assunto para ser discutido
pelos religiosos, e quem já foi espero que não volte
para contar como é este lugar tão temido pela
humanidade. No entanto, podemos fazer uma análise do
inferno nos baseando no conceito dos processos
endotérmicos e exotérmicos. Mas primeiramente uma
definição dos diferentes tipos de reação frente ao
calor: Processo Endotérmico: é aquele que ocorre com absorção de calor.
Processo Exotérmico: é aquele que ocorre com liberação de calor.
Agora uma pergunta: a que taxa as almas se movem para fora e para dentro do inferno? A resposta iremos ignorar, assumindo a seguinte posição: uma vez que uma alma entra no abismo ela nunca sai, apesar de algumas religiões defenderem o contrário. Portanto, existem várias previsões para as almas que entram para o inferno, sendo que, cada crença defende sua posição.
Por exemplo, algumas religiões assumem ser a única regra de fé, sendo assim, se você não seguir os princípios que ela prega, você vai para as trevas e não para a luz. Supondo então que quase todos fossem arder no “mármore do inferno”, como ficaria este lugar? Se não há almas saindo e com as taxas de mortalidade crescendo em ritmo acelerado, o que se pode esperar é um aumento assustador das almas condenadas, ou seja, uma superpopulação do inferno.
De acordo com a Lei de Boyle e seu princípio fundamental: Sob temperatura constante, o produto da pressão e do volume de uma massa gasosa é constante, sendo assim, para a temperatura e a pressão no inferno serem as mesmas, a relação entre a massa das almas e o volume do inferno deve ser constante.
Seguindo este raciocínio, temos então duas opções: Imagine só se a taxa de almas que são enviadas diariamente para o Lúcifer for maior que a taxa de expansão do inferno, vai ocorrer então uma explosão, devido ao aumento de temperatura e pressão. Agora se o inferno sofre uma expansão maior do que a entrada de almas, ocorrerá exatamente o inverso, a pressão e a temperatura serão tão mínimos que o inferno irá se congelar.
Voltando a pergunta inicial: O inferno é endotérmico ou exotérmico? Levando em consideração tudo que já foi proposto sobre o inferno, é mais fácil acreditar que é exotérmico e que a temperatura e a pressão aumentam cada vez mais: é um verdadeiro fogo que queima sem cessar!
O pH E A COLORAÇÃO DAS HORTÊNSIAS
 As
hortênsias são flores muito belas que possuem uma
característica única: a coloração desta flor depende do
solo que a comporta. O pH exerce importantes influências
nas plantas em geral, a acidez está ligada até mesmo à
produtividade do solo. Solos muito ácidos podem não
produzir bem, é por isso que é de costume dos
agricultores fazer queimadas das plantações para
neutralizar o pH do solo, isso é possível pelo fato das
cinzas produzidas serem alcalinas.
As
hortênsias são flores muito belas que possuem uma
característica única: a coloração desta flor depende do
solo que a comporta. O pH exerce importantes influências
nas plantas em geral, a acidez está ligada até mesmo à
produtividade do solo. Solos muito ácidos podem não
produzir bem, é por isso que é de costume dos
agricultores fazer queimadas das plantações para
neutralizar o pH do solo, isso é possível pelo fato das
cinzas produzidas serem alcalinas.  Mas
no que se refere às hortênsias, o pH produz as seguintes
alterações: as plantadas em solos alcalinos, com pH
elevado, produzem as flores com coloração rosa, já as
que se encontram em solo ácido, com pH inferior, são
responsáveis pelas flores azuis.
Mas
no que se refere às hortênsias, o pH produz as seguintes
alterações: as plantadas em solos alcalinos, com pH
elevado, produzem as flores com coloração rosa, já as
que se encontram em solo ácido, com pH inferior, são
responsáveis pelas flores azuis. O pH do solo varia de acordo com a região em que está localizado, as regiões ricas em calcário correspondem aos solos alcalinos (pH ≥ 7). Os solos argilosos provenientes de regiões úmidas como margem de rios e pântanos são ácidos (pH ≤ 7).
 Quando
precisamos colar algo surge aquela dúvida: qual o melhor tipo de cola? Ao
contrário do que muita gente pensa, existe um tipo de cola para cada
material específico. O princípio fundamental é a afinidade da cola, ela
precisa combinar com a superfície que for colar. Por exemplo, uma cola de
tecido não serve para colar materiais plásticos, e vice-versa. É com base
nesse princípio que existe uma variedade de colas disponíveis no mercado:
cola de sapateiro, cola branca (PVA), cola quente, cola instantânea, cola de
silicone, etc.
Quando
precisamos colar algo surge aquela dúvida: qual o melhor tipo de cola? Ao
contrário do que muita gente pensa, existe um tipo de cola para cada
material específico. O princípio fundamental é a afinidade da cola, ela
precisa combinar com a superfície que for colar. Por exemplo, uma cola de
tecido não serve para colar materiais plásticos, e vice-versa. É com base
nesse princípio que existe uma variedade de colas disponíveis no mercado:
cola de sapateiro, cola branca (PVA), cola quente, cola instantânea, cola de
silicone, etc.
Sigas os passos de como fazer uma colagem bem feita:
1. Escolher: Antes de tudo é preciso escolher a cola mais
adequada, essa escolha depende do material a ser colado, por exemplo, por
que se usa a mesma cola para colar madeira e papel sendo que estes dois
objetos aparentam tanta diferença (o papel é mole e perecível e a madeira é
dura e resistente)?. Na verdade, esses objetos possuem em sua composição uma
matéria básica em comum: a celulose, até por que a matéria prima para a
fabricação de papel é a madeira. Feita a escolha do material é só passar
para o 2º passo:
2. Limpar: Fazer uma limpeza criteriosa do local a ser
colado é importante, pois sujeiras como poeira e óleos, por exemplo, podem
ser prejudiciais no processo.
3. Colar: A cola deve ser adicionada de forma uniforme
sobre toda a superfície, é por isso que tem que ser totalmente atraída pelo
material a ser colado.
O fato da cola ser atraída pela superfície de contato não basta para uma
colagem eficiente. Se você observar criteriosamente uma superfície com a
ajuda de um microscópio, vai ver que não é tão lisa como parece a olho nu,
pelo contrário, é porosa e irregular. É justamente este aspecto que auxilia
o processo, a cola penetra nos orifícios e se adere melhor ao objeto.
Outra pergunta que pode surgir é a seguinte: Por que a cola seca? As colas
em geral são líquidas, ou seja, contêm água em sua composição. Quando você
cola um objeto e o deixa ao ar livre, ocorre a perda de água (evaporação) da
parte líquida da cola.
 Alguma
vez você já ouviu essa indagação? É uma dúvida que está perturbando os
antigos conhecimentos que tínhamos sobre o vidro, que até então era
conhecido como sendo um objeto no estado sólido. Mas qual a verdadeira forma
do vidro: sólida ou líquida?
Alguma
vez você já ouviu essa indagação? É uma dúvida que está perturbando os
antigos conhecimentos que tínhamos sobre o vidro, que até então era
conhecido como sendo um objeto no estado sólido. Mas qual a verdadeira forma
do vidro: sólida ou líquida?
Já sabemos que o vidro é um material inorgânico que possui a sílica como
elemento básico. O procedimento de preparo dos vidros consiste em aquecer um
líquido até altas temperaturas e depois resfriar este líquido até a
temperatura ultrapassar o ponto de congelamento, tornando-o rígido antes que
a solidificação tenha início.
Observe que o que ocorre é um supercongelamento desse líquido. Esse fenômeno
ocorre por resfriamento brusco a temperaturas muito abaixo do ponto de
congelamento. Quando um líquido chega a esse ponto, sua viscosidade torna-se
muito alta, adquire maior dureza, rigidez e forma constante, ou seja, ele se
torna semelhante aos sólidos.
Para ser sólido o vidro teria que apresentar estrutura cristalina definida,
o que não é o caso, pois não possui estrutura microscópica periodicamente
organizada. É o que chamamos de sólido amorfo, ou seja, um líquido com
viscosidade enorme. Relatos já afirmaram que o vidro escorre se baseando nos
vitrais das catedrais antigas, onde existe uma diferença de grossura no topo
e na base dos citados vitrais. Mas não existe uma confirmação científica
sobre este acontecimento.
O correto é considerar o vidro como sendo um líquido com viscosidade muito
elevada, mesmo que isso pareça estranho aos nossos conceitos sobre a
individualidade deste material.
 Qual
substância é responsável por aquela sensação de “boca pegando fogo”? O
ardido da pimenta tem sua origem muito além da composição, a explicação vem
do cérebro: o que faz nossa língua formigar é uma substância presente em
abundância na pimenta que é capaz de enviar mensagens ao nosso
subconsciente.
Qual
substância é responsável por aquela sensação de “boca pegando fogo”? O
ardido da pimenta tem sua origem muito além da composição, a explicação vem
do cérebro: o que faz nossa língua formigar é uma substância presente em
abundância na pimenta que é capaz de enviar mensagens ao nosso
subconsciente.
Você já reparou que a parte mais ardida da pimenta é a semente? E é
justamente lá que se encontram as capsaicinóides, a função destas
substâncias é proteger a pimenta contra o ataque de fungos, é por isso que o
vegetal precisa ter um sistema de autodefesa.
O homem utiliza desta propriedade da pimenta para conferir a alimentos
preparados um sabor todo especial. Veja por que sentimos a língua queimando
quando ingerimos pimenta:
Ao colocar pimenta na boca, essa entra em contato com a língua e libera as
capsaicinóides, que ativam no mesmo instante um receptor de dor do cérebro
denominado de nervo trigêmeo. Como o próprio nome já diz, esse nervo liga 3
órgãos: a boca, o nariz e os olhos. É daí que se explicam a irritação no
nariz, os olhos lacrimejando, além da boca pegando fogo quando se ingere uma
daquelas pimentas bem fortes, como a malagueta por exemplo.
Uma dica: acabe com ao ardor da pimenta ingerindo leite, o leite neutraliza
a ação dos capsaicinóides.
 A
pólvora clássica (explosiva) é constituída por 75% de
Salitre, 15% de carvão e 10% de enxofre. O principal
componente - o salitre ou Nitrato de Sódio, cuja
composição química é (NaNO3), possui alto
poder de combustão e explosão. Ao longo dos séculos, a
composição da pólvora sofreu algumas alterações, de
acordo com o que se destinava, surgindo a pólvora de
caça, de minas e de guerra.
A
pólvora clássica (explosiva) é constituída por 75% de
Salitre, 15% de carvão e 10% de enxofre. O principal
componente - o salitre ou Nitrato de Sódio, cuja
composição química é (NaNO3), possui alto
poder de combustão e explosão. Ao longo dos séculos, a
composição da pólvora sofreu algumas alterações, de
acordo com o que se destinava, surgindo a pólvora de
caça, de minas e de guerra.
A história revela que a pólvora foi descoberta na China
no Século IX e depois espalhada pelo mundo. A descoberta
foi acidental e feita por alquimistas que procuravam
pelo elixir da imortalidade, isso explica por que as
primeiras referências à pólvora aparecem como avisos em
textos de alquimia: “Não misturem certos materiais
uns com os outros.”
A pólvora pode ser classificada em:
• Propelente: se queima
mais lentamente e constante, é a pólvora usada nas
munições.
• Explosiva: de queima média e alta
velocidade, é por isso que gera grande volume de gás e
explode se estiver confinada. É usada basicamente para
fogos de artifício (pólvora negra).
Por volta do século X, a pólvora começou a ser usada com
propósitos militares na China, era encontrada na forma
de foguetes e bombas explosivas lançadas de catapultas.
O canhão surgiu em 1126, quando foram utilizados tubos
feitos de bambu para se lançarem mísseis contra o
inimigo. Posteriormente, os tubos de bambu foram
substituídos por tubos de metal. Depois da China, o uso
militar da pólvora se espalhou para o Japão e a Europa.
Por volta do ano de 1304, na Arábia, a pólvora foi usada
pela primeira vez para lançar projéteis de uma arma
portátil de tamanho semelhante ao dos rifles.
PROTETOR SOLAR: QUAL O PRINCÍPIO?
 Antes
de sair para praia, ou curtir uma piscina ele se faz essencial! Além de
hidratar ele protege a pele contra aquele “sol de rachar”. Mas não é somente
no verão que devemos abusar do protetor solar, no inverno a pele pode ficar
exposta a ação de ventos frios e secos e adquirir aparência ressecada, o
aspecto não é nada agradável, além de incomodar.
Antes
de sair para praia, ou curtir uma piscina ele se faz essencial! Além de
hidratar ele protege a pele contra aquele “sol de rachar”. Mas não é somente
no verão que devemos abusar do protetor solar, no inverno a pele pode ficar
exposta a ação de ventos frios e secos e adquirir aparência ressecada, o
aspecto não é nada agradável, além de incomodar.
O que muita gente não sabe é como o protetor age sobre a pele, sua principal
função é impedir que os raios solares nocivos sejam absorvidos pelo
organismo. A ação consiste em proteger a derme e epiderme da radiação UVA e
UVB, veja como isso acontece: A derme é a camada interna da pele, ela
absorve os raios ultravioleta UVA, e a radiação UVB é absorvida pela
epiderme, que é a camada mais externa da pele.
Os protetores em geral possuem fórmulas químicas que atuam na proteção, mais
precisamente as moléculas presentes nesse produto, que quando aplicadas na
pele absorvem a energia solar. Essas moléculas ficam agitadas devido à
absorção, mas ao passar o estado de excitação elas voltam ao estado normal.
Este processo permite que a pele receba uma fração de sol menos agressiva, e
ao mesmo tempo faz com que não absorva a radiação que pode dar origem ao
câncer de pele.
Você sabe o que significa fator de proteção solar? A sigla FPS que vem
acompanhada de um número nas embalagens de protetor solar tem um significado
muito importante: indica quanto tempo você pode ficar exposto ao sol após
ter aplicado a loção protetora. Se o FPS de seu protetor for 15, significa
que poderá permanecer no sol por um período 15 vezes maior do que se
estivesse sem proteção, ou seja, oferece segurança ao usuário enquanto
estiver sobre a pele, não a deixando avermelhada. Uma dica é usar protetor
solar sempre, independente da estação do ano.
QUÍMICA DO CABELO: ph DO XAMPU
 Os
xampus que andam mexendo com a cabeça da mulherada são os xampus com pH
neutro. Essa onda garante beleza e proteção às madeixas, além de conservar
melhor os modernos tratamentos, tudo porque esse xampu possui a propriedade
de não agredir os cabelos, será verdade? Existe uma explicação científica
para esse fato?
Os
xampus que andam mexendo com a cabeça da mulherada são os xampus com pH
neutro. Essa onda garante beleza e proteção às madeixas, além de conservar
melhor os modernos tratamentos, tudo porque esse xampu possui a propriedade
de não agredir os cabelos, será verdade? Existe uma explicação científica
para esse fato?
Antes de explicar como os xampus auxiliam nos tratamentos capilares, vejamos
em que consiste a estrutura dos cabelos. Um fio de cabelo contém moléculas
que se ligam de maneiras diferentes, a estrutura do cabelo muda conforme a
ligação.
São basicamente três formas de ligações moleculares presentes nos cabelos:
pontes salinas, ligações de hidrogênio e pontes de
dissulfeto. O segredo dos xampus está justamente aqui: mudar as
interações que formam o fio de cabelo.
Para exemplificar, vejamos como mudar o visual apenas molhando o cabelo.
Você já observou que os cabelos molhados tendem a permanecer sem volume? As
pessoas com cabelos rebeldes usam dessa propriedade para compor um visual
mais agradável, mas o problema é que quando secos, os cabelos voltam à
posição inicial.
A explicação científica para este fato é que quando os fios de cabelo são
molhados as ligações de hidrogênio presentes se quebram, mas ao secarem
estas ligações são novamente formadas. Foi baseada nesta teoria que surgiram
os xampus com pH neutro.
Quando o cabelo é lavado com xampu ácido (pH ≈ 1,5), além das ligações de
hidrogênio, são quebradas também as pontes salinas, o resultado é o cabelo
rebelde e seco. E não adianta procurar um xampu com pH elevado (pH ≥ 8),
estes são os piores, pois são responsáveis pelo aparecimento das famosas
pontas duplas, em razão das quebras das pontes de dissulfeto presentes nas
extremidades dos cabelos.
Então, qual é o xampu ideal para manter os cabelos fortes e saudáveis? O
recomendável é usar xampus com pH entre 4,0 e 5,0 (pH moderado). Com base
nestas informações é possível formular um xampu ideal para seus cabelos,
além de aprender mais sobre pH ainda ganhará um visual novo.
As papilas são os quimiorreceptores responsáveis por sentirmos o sabor dos alimentos e classificá-los. Por exemplo, sentimos o doce dos alimentos através das papilas presentes na frente da língua, afinal por que gostamos tanto do sabor adocicado? Essa explicação pode vir de nossos ancestrais que se alimentavam basicamente de frutas: as frutas maduras são doces, as verdes são ácidas e as venenosas são amargas. Como é comum a preferência por frutas maduras e não venenosas, o paladar foi evoluindo para chegar à preferência pelo doce. É por isso que alimentos ricos em açúcar são os preferidos e nos causam “água na boca”.
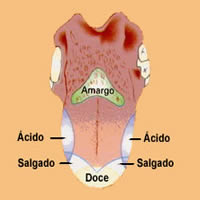
O apetite por determinados alimentos está ligado às moléculas que evocam sabor presentes em nossa boca, essas moléculas são denominadas de saporíferas (do latim sapere = provar). Como o próprio nome já diz, as moléculas saporíferas aguçam nosso paladar, daí o porquê deste órgão dos sentidos humanos ter sua explicação na química.
 A
excitação dos elétrons produz energia capaz de gerar luz: é o fenômeno
chamado de fluorescência.
A
excitação dos elétrons produz energia capaz de gerar luz: é o fenômeno
chamado de fluorescência.
Você já usou pulseiras de Neon? Nas festas de casamento, formaturas, festas
em geral, elas se tornaram a sensação do momento, encantando as pessoas pela
luz que emitem em meio à penumbra das boates. Essas luzes equivalem à
fluorescência do gás Neon (Ne, décimo elemento
da tabela periódica, do grupo dos gases nobres) mediante a passagem de uma
corrente elétrica.
O Neon é obtido do ar atmosférico pelo processo da liquefação fracionada e é
muito utilizado comercialmente. O processo de obtenção consiste no
resfriamento do ar até que esse fique liquefeito gradativamente e preparado
para aquecer. Os chamados luminosos de Neon são muito usados na publicidade:
iluminação de anúncios comerciais, em letreiros luminosos com o intuito de
chamar a atenção do público, basta olhar para a cidade à noite que veremos
luzes de Neon.
Entenda agora como funcionam esses luminosos: são semelhantes às lâmpadas
fluorescentes, onde os elétrons presentes são excitados até que retornem à
órbita original. Essa órbita energizada emite luz, que só é transmitida
enquanto há fornecimento de energia. Se o abastecimento for interrompido, ou
seja, quando os elétrons retornam à estabilidade, cessa a emissão de
energia.
A quimioluminescência consiste na emissão de luz gerada por
uma reação química, é a que encontramos nas “pulseirinhas de gás Neon”, que
podem emitir várias cores, dependendo da pressão do gás e de sua composição.
Observe a composição do gás e suas cores respectivas:
Neônio (Ne) + Gás carbônico (CO2)
→ luz violeta
Neônio (Ne) + Mercúrio (Hg) →
luz azul
Neônio (Ne) puro → luz vermelha
A bioluminescência ocorre em organismos vivos, ela é encontrada
principalmente no fundo do oceano, mas vaga-lumes também possuem esta
habilidade.
RECEITAS DE SABÃO COM ÓLEO DE FRITURA

Depois de usado, o óleo de cozinha pode ter dois destinos: dar uma enorme dor de cabeça e prejuízo para o seu bolso e para o meio ambiente ou se transformar em economia e, eventualmente, em receita extra.
O primeiro caso ocorre quando você simplesmente descarta o óleo doméstico nos ralos e vasos sanitários. O acúmulo de gorduras nos encanamentos pode causar entupimentos, refluxo de esgoto e até rompimentos nas redes de coleta. No segundo caso está transformar esse mesmo óleo em sabão. O sabão pode ser feito em casa mesmo ou enviado a empresas que o transformam em produto de limpeza ou biodiesel.
Fazer sabão em casa é como cozinhar. Com a prática, seguindo a mesma receita, o sabão vai ficando melhor. A proporção pode ser mantida para fazer mais ou menos sabão, de acordo com a quantidade de óleo usado disponível.
É recomendado usar luvas e utensílios de madeira ou plástico para preparar a mistura, pois a soda cáustica pode causar queimaduras na pele.
Confira as receitas:
Não esqueça de filtrar o óleo de fritura, deixando sem resíduo algum (pode ser usado filtro de café, é demorado mas garante uma boa qualidade.
1ª OPÇÃO
MATERIAIS
- 500ml de óleo
- 100g de soda cáustica
- 100ml de água
- 30ml de detergente
- 50ml de álcool
MÉDODO
1º
- passo coloque o óleo em um balde e dê umas esguichadas de detergente de
cozinha mesmo (uns 30ml) e mexa bem;
2º - acrescente a soda já diluída em 100ml de água e mexa bem;
3º - esse é o mais importante, depois que tudo estiver bem misturado por
ultimo você acrescentará 50ml de álcool, mexa rápido e despeje numa forma
antes que o sabão endureça por completo
2ª OPÇÃO
MATERIAIS
- 4 L de óleo comestível usado
- 2 L de água
- 1/2 copo de sabão em pó
- 1 Kg de soda cáustica (NaOH)
- 5 ml de essência aromatizante (opcional)
MÉDOTO
1º - Dissolver o sabão em pó em 1/2 L de água quente
2º - Dissolver a soda cáustica em 1 e ½ L de água quente
3º - Adicionar lentamente as duas soluções ao óleo
4º - Mexer por 20 minutos
5º - Adicionar a essência aromatizante
6º - Despejar em formas
7º - Desenformar no dia seguinte
RELAÇÃO DO CHOCOLATE E OS ABALOS EMOCIONAIS
 O
rompimento de uma relação amorosa pode trazer
conseqüências ao organismo como: ansiedade permanente,
insônia, irritação, prostração e desinteresse pelo
mundo. E é aí que entra o chocolate: quem nunca viu uma
cena parecida ou até mesmo recorreu a essa deliciosa
guloseima num momento de carência emocional?
Há quem garanta que comer chocolate
dá uma sensação de prazer e felicidade, há mesmo uma
explicação para esse fenômeno?
O
rompimento de uma relação amorosa pode trazer
conseqüências ao organismo como: ansiedade permanente,
insônia, irritação, prostração e desinteresse pelo
mundo. E é aí que entra o chocolate: quem nunca viu uma
cena parecida ou até mesmo recorreu a essa deliciosa
guloseima num momento de carência emocional?
Há quem garanta que comer chocolate
dá uma sensação de prazer e felicidade, há mesmo uma
explicação para esse fenômeno? O papel da Química no fascínio de tanta gente por essa iguaria começa bem antes da embalagem ser aberta, o chocolate possui sim uma capacidade incomum para interagir com a química cerebral, pelo menos é o que estudos mostram. Foram identificadas 500 substâncias químicas responsáveis pelo sabor do chocolate. Entre elas, podemos citar os compostos carbonílicos como os álcoois, aldeídos, cetonas, e os heterocíclicos. Mas a sensação de bem-estar que esse alimento causa, está ligada ao estímulo da produção de serotonina no corpo humano.
O chocolate contém um aminoácido chamado triptofano, responsável pela produção de serotonina no cérebro. A serotonina recebe quimicamente o nome 5-hidroxitriptamina e é representada pela fórmula molecular N2OC10H12, é a "substância química do bem estar", é responsável pela sensação de felicidade e prazer.
No período pré-menstrual ocorrem alterações nos níveis hormonais do organismo feminino: cai a produção de serotonina e o déficit desse neurotransmissor, e como conseqüência aumenta a sensação de tristeza e abatimento, tornando as mulheres mais irritáveis e deprimidas. Por isso, neste período elas costumam sair correndo atrás de um chocolate para suprir a carência.
RELAÇÃO DA PRESSÃO DE VAPOR E PIPOCA

Você já se perguntou por que o milho para pipoca
estoura?
A resposta a esta pergunta está relacionada com o conteúdo “Pressão de
vapor”, veja então uma definição para pressão:
Relação entre a força exercida na direção perpendicular sobre uma dada
superfície e a área dessa superfície.
O mistério que envolve a pipoca já era discutido até por algumas tribos
indígenas americanas, elas começaram a fazê-la com a espiga inteira colocada
num espeto e levada ao fogo. Com relação à pipoca estourar, eles costumavam
dizer que os espíritos viviam dentro de cada grão de pipoca. Os espíritos
viviam em paz, mas quando suas "casas" eram aquecidas eles ficavam furiosos,
fazendo com que o grão pulasse e finalmente estourasse libertando o
espírito, que saía sob a forma de uma névoa.
Mas o que acontece é bem mais concreto: A "explosão" de um grão de pipoca
quando aquecido é o resultado da combinação de 3 fatores:
1. Além de amido, o interior do grão (endosperma) contém
cerca de 12% de água;
2. O endosperma é um excelente condutor de calor.
3. O exterior do grão (pericarpo) apresenta grande
resistência mecânica, é duro e raramente possui falhas (rachaduras).
Quando os grãos de milho são aquecidos a umidade interna (endosperma) é
convertida em vapor, ou seja, sofre vaporização. Em um determinado ponto, o
ar retido tenta expandir-se e as moléculas se movimentam com tanta rapidez
no interior do milho que desta forma pressionam fortemente as paredes
resistentes, até que elas se rompem e os grãos de milho explodem e se tornam
maiores do que o grão original.
O pericarpo atua como uma panela de pressão, evitando a saída do vapor de
água até que certa pressão limite seja atingida. Neste ponto, ocorrem duas
coisas: o grão explode, com som característico (pop!) e o amido do
endosperma incha abruptamente, e se transforma no floquinho branco de
textura macia que chamamos de pipoca.
A explosão da pipoca nada mais é que a expansão do vapor de água dentro do
grão, essa é a verdadeira explicação científica para o estouro da pipoca.
Por que a carne amolece quando colocamos caldo de abacaxi?

A adição de suco de abacaxi fresco numa carne proporciona um amolecimento absoluto, mas cuidado se acrescentar demais a carne ficará com gosto de abacaxi.O suco de abacaxi tem enzimas, moléculas que favorecem as diversas reações dos seres vivos, podemos chamá-las de catalisadores biológicos.Encontramo-las em todas as células vivas e, sobretudo, no suco de abacaxi ou de mamão fresco. Essas enzimas específicas do abacaxi ou do mamão (respectivamente a bromelina e a papaína) têm uma particularidade, são proteolíticas, isto é, degradam as proteínas. Ora, a carne é composta de numerosas proteínas, sobretudo colágeno, responsável pela dureza da carne. O suco de abacaxi ou do mamão, fresco, degrada a proteína chamada "colágeno" deixando a carne mais macia.Mas, cuidado se acrescentar demais a carne vira uma "papa".
![]()
É um polímero derivado do petróleo. Muito utilizado em medicina para próteses, alem de ser útil para diversificadas funções como por exemplo; impermeabilização, lubrificação, polimento, etc. Ele não possui átomos de carbono em sua cadeia principal, por esse motivo não é considerado um polímero orgânico.
Silicone nos seios
![]()
O implante de silicone nas mamas é realizado normalmente através de cirurgia. Onde o médico faz uma pequena incisão por onde implanta a prótese de silicone em forma de gel, embalada por uma membrana resistente e maleável.
Ela é posicionada por entre as glândulas mamária e o músculo peitoral e precisa ser trocada depois de 15 ou 20 anos.
TATUAGENS SOBRE O PONTO DE VISTA QUÍMICO
 A
Tabela Periódica dos elementos químicos é um arranjo que
permite não só verificar as características dos
elementos, mas também fazer previsões de como esses se
comportam frente às reações. Os elementos da Família
B da tabela são
denominados Elementos de transição e são objetos de
nosso estudo sobre as tatuagens.
A
Tabela Periódica dos elementos químicos é um arranjo que
permite não só verificar as características dos
elementos, mas também fazer previsões de como esses se
comportam frente às reações. Os elementos da Família
B da tabela são
denominados Elementos de transição e são objetos de
nosso estudo sobre as tatuagens. Os elementos de transição possuem a propriedade de formar compostos coloridos, devido a essas características são usados para muitos fins como: fabricar vidros coloridos e nas tatuagens.
As tatuagens já existem há alguns anos, mas seu uso ultimamente se intensificou. A prática de se tatuar já foi vítima de preconceitos, que relacionavam as pessoas tatuadas com marginais. Embora atualmente ainda ocorra discriminação, as tatuagens são vistas com naturalidade, principalmente pelo público jovem.
As tatuagens podem ter vários significados, por exemplo, em alguns grupos sociais elas funcionam como forma de comunicação não-verbal, e servem para identificar os membros de um mesmo grupo, tribo ou sociedade. Existe uma máfia japonesa conhecida por Yakusa, cujos membros utilizam tatuagens para se identificar e indicar sua lealdade ao grupo.
Existem dois tipos de tatuagem:
Temporárias: são conhecidas como tatuagens de Hena, este nome provém da planta da qual é retirada a pigmentação: a Henna lausonia inermes. Essa planta é originária da Índia e países do Oriente Médio, sua coloração natural é marrom ou ferrugem e não possui efeito tóxico. O risco está na adição de carbono e de substâncias contendo chumbo e mercúrio para obtenção da cor preta.
Definitivas: é preciso pensar muito antes de optar por este tipo de tatuagem, que como o próprio nome indica, é definitiva. Só existe uma forma de removê-la, que é através de laser: um processo doloroso e o resultado final não é muito satisfatório, pois no lugar da tatuagem fica uma cicatriz.
A técnica utilizada nas tatuagens permanentes consiste em introduzir na derme com o auxílio de agulhas, pigmentos que ficam retidos nas células da pele. Os pigmentos mais comuns e suas cores específicas estão relacionados abaixo:
Pigmento Cor
Sulfeto de Mercúrio ........................................................ Preto
Carbono (carvão) ....................................................... Preto
Sais de cádmio ....................................................... Amarelo ou vermelho
Sais de crômio ....................................................... Verde
Sais de ferro ......................................................... Castanho, rosa e amarelo
Óxido de Titânio ......................................................... Branco
Sais de cobalto ........................................................... Azul
 Os
filósofos gregos que viveram no século 6 a.C. defendiam
a existência de quatro elementos na composição de tudo o
que existe: fogo, terra, água e ar. Não podemos
desprezar a idéia destes antigos cientistas, afinal,
nós, as pedras, a água, as estrelas somos formados de
poucos ingredientes e da forma que interagem entre si.
Os
filósofos gregos que viveram no século 6 a.C. defendiam
a existência de quatro elementos na composição de tudo o
que existe: fogo, terra, água e ar. Não podemos
desprezar a idéia destes antigos cientistas, afinal,
nós, as pedras, a água, as estrelas somos formados de
poucos ingredientes e da forma que interagem entre si.
Para entender melhor, olhe seu dedo e observe a cutícula, agora imagine se este pedacinho de pele fosse esticado até que ficasse do tamanho de um prédio de 100 andares, é difícil acreditar, mas neste pequeno espaço existe um universo: o mundo quântico, habitado pelas partículas subatômicas. Essas partículas é que são os elementos fundamentais da natureza, não é Terra, água, fogo e ar como supunham os antigos filósofos gregos, a interação entre essas partículas é que dão origem a tudo que existe.
Conheça agora as partículas subatômicas, também conhecidas como os SETE ELEMENTOS:
1. Neutrino: a forma de matéria mais leve que existe, é chamada de partícula fantasma por que quase não interage. Mas de onde surge o neutrino? Ele aparece dentro do núcleo atômico, quando um próton se transforma em nêutron (ou vice-versa), podemos encontrar esta partícula na reação que ocorre nos átomos de hidrogênio do sol e até dentro de nós.
2. Elétron: esta partícula habita a eletrosfera do átomo. Esta é a maior parte do átomo, para se comparar imagine o átomo do tamanho de um grão de areia e a praia equivale a eletrosfera, que como se vê é bem maior! São eles que produzem as lâmpadas responsáveis pela luz, e imagine só: a televisão existe graças aos elétrons, eles chocam-se contra a tela da televisão e fazem a imagem aparecer.
3. Quarks: são os tijolos que a natureza utiliza para construir prótons e nêutrons, são as superpartículas. Fazem parte do núcleo atômico e possuem “carga elétrica” de cores variadas: verde, vermelha ou azul;
4. Glúons: são chamados de Força Nuclear Forte, e possuem a maior força do Universo, inclusive maior que a força da gravidade. Mas quando estas partículas se desfazem a Força Nuclear deixa de existir e acontece uma fissão nuclear: o átomo é dividido em dois;
5. Bósons da Força Fraca: estas partículas são as causadoras da radioatividade, são elas que destroem os átomos, apesar do nome são essenciais: sem elas o Sol não existiria, têm a capacidade de transformar prótons em nêutrons, é esta a reação que dá origem ao brilho do sol;
6. Fótons: partículas da força eletromagnética responsável por manter os elétrons em torno do núcleo, a segunda maior força do Cosmos, os fótons originam o sinal do rádio, do celular e ainda dos raios X.
7. Gráviton: é a força responsável pela gravidade.
VINHO E CARNE: A QUÍMICA DESTA COMBINAÇÃO
 Quem
diria... uma combinação deliciosa e tentadora que pode trazer benefícios ao
organismo, estamos falando da mistura entre vinho tinto e a tão temida carne
vermelha. Já estamos cansados de ouvir falar que a carne mais saudável é a
branca, mas para alguns é impossível resistir àquela picanha mal passada.
Quem
diria... uma combinação deliciosa e tentadora que pode trazer benefícios ao
organismo, estamos falando da mistura entre vinho tinto e a tão temida carne
vermelha. Já estamos cansados de ouvir falar que a carne mais saudável é a
branca, mas para alguns é impossível resistir àquela picanha mal passada.
Eis então uma notícia que vai aliviar sua consciência: o vinho ajuda a
eliminar substâncias nocivas à saúde. O MDA (3,4-
metilenodioxianfetamina) é uma substância perigosa presente nas
carnes vermelhas, ele é produto da oxidação das gorduras insaturadas
presentes nas carnes, o acúmulo no organismo pode levar ao câncer já que o
MDA é um carcinogênico. Então como uma simples bebida pode inibir a ação
desta gordura? O vinho é rico em polifenóis, uma vez que estes compostos
orgânicos se fazem presente no estômago, “varrem” por completo os radicais
livres, MDA e outras substâncias maléficas.
Se você não for chegado em bebidas alcoólicas pode optar em acrescentar o
ingrediente a uma receita que leve carne ao molho de vinho, além de obter um
prato mais requintado e apetitoso garante a consciência limpa para apreciar
à vontade a guloseima.
Uma outra opção seria aquele frango assado combinado a um vinho, os
benefícios são os mesmos para ambos os tipos de carne. Daí você pode se
perguntar: e o vinho branco, é também benéfico? O tipo de uva empregado para
se obter este tipo de vinho é diferente, se trata das uvas claras. Mas a boa
notícia é que, apesar da quantidade de polifenóis no vinho branco ser menor
do que no vinho tinto, um preparo adequado das uvas garante um vinho claro e
igualmente benéfico.
Esta dica não poderia vir em melhor hora, já que as festas de fim de ano se
aproximam: então deguste um bom churrasco e brinde com um delicioso vinho
tinto!
 Por
que sentimos as terríveis cãibras? Aquela dorzinha incômoda que
aparece principalmente quando estamos em meio a uma maratona de exercícios.
A resposta vem do nosso cérebro, a cãibra é uma contração espasmódica
(espasmo muscular que acontece involuntariamente) dos músculos. É uma
contração súbita, de curta duração e dolorosa, de um músculo ou de um grupo
muscular, geralmente ocorre na panturrilha e pé.
Por
que sentimos as terríveis cãibras? Aquela dorzinha incômoda que
aparece principalmente quando estamos em meio a uma maratona de exercícios.
A resposta vem do nosso cérebro, a cãibra é uma contração espasmódica
(espasmo muscular que acontece involuntariamente) dos músculos. É uma
contração súbita, de curta duração e dolorosa, de um músculo ou de um grupo
muscular, geralmente ocorre na panturrilha e pé.
Nosso cérebro possui uma placa motora localizada entre nervo e músculo, e
como nossos músculos se contraem o tempo todo, disparam cargas elétricas
dentro do cérebro. Essa carga elétrica altera o equilíbrio entre dois
minerais: potássio e sódio.
O potássio se encontra dentro da fibra muscular e o sódio fora dela, este é
o ponto principal do contexto: a ordem dos minerais dentro do músculo. A má
alimentação causa um desequilíbrio nos teores de sódio e potássio, há uma
inversão de posição dos minerais presentes, o sódio entra na fibra e o
potássio sai da fibra: o músculo então se contrai involuntariamente. Essa
contração é denominada de cãibra.
Outro fator que pode levar a este incômodo é a fadiga muscular. O corpo é
obrigado a tirar energia de onde puder, então, retira-a do glicogênio
(açúcar do músculo). Quando o glicogênio se desfaz grande quantidade de
ácido láctico é liberada, esse ácido penetra na placa motora e dificulta o
disparo da carga elétrica, o ambiente fica mais carregado e ácido, ou seja,
mais propenso a cãibras.
Existe uma maneira de evitar esta dor intensa? O recomendável é ingerir
alimentos ricos em potássio e cálcio, já reparou como alguns jogadores de
tênis comem bananas? Parecem até macacos, mas eles sabem o que fazem: essa
fruta é uma fonte de minerais, mais precisamente de potássio. É essencial
manter uma dieta balanceada, não só para prevenir cãibras, mas por uma série
de doenças vinculadas à falta de minerais no organismo, por exemplo, a
osteoporose.
REFERÊNCIAS
Este site foi atualizado em 04/03/19